新学術創成研究機構革新的統合バイオ研究コア セルバイオノミクスユニットおよび理工研究域バイオAFM先端研究センター分子・細胞部門のリチャード・ウォング教授らの研究グループは,理工研究域バイオAFM先端研究センターの安藤敏夫特任教授らが開発した世界最速の原子間力顕微鏡を用いて,大腸がん細胞の核の表面に存在する核膜孔を可視化し,さらに抗がん剤として期待される薬剤による核膜孔の変化を世界で初めてビデオ撮影することに成功しました。
核膜孔は細胞の核を覆う膜にある穴で,細胞質と核の間の物質輸送における唯一の通り道です。脊椎動物の核膜孔は核膜孔複合体(NPC)と呼ばれる約120メガダルトン(MDa)の巨大タンパク質複合体であり,直径120ナノメートル(nm)の筒状チャネル(※1)であると考えられていますが,これまで,この脊椎動物の小さな核膜孔が動いている様子を観察した事例はありませんでした。
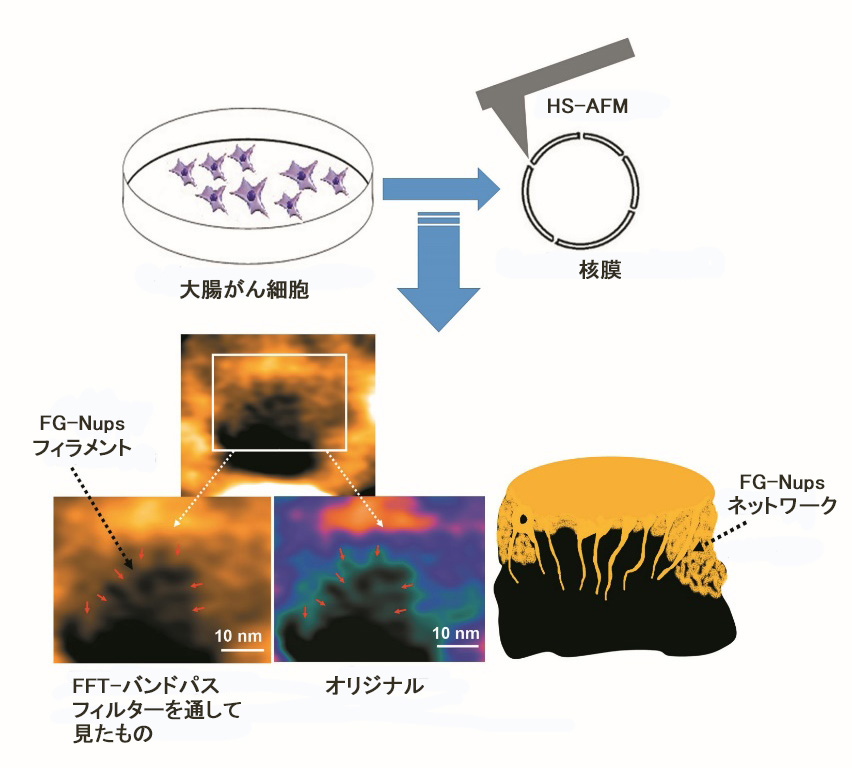
今回,本研究グループは,特別な方法でヒト大腸がん細胞から核膜を生きたまま取り出し,本学が開発した分子の動きや構造を精密に撮影できる高速原子間力顕微鏡(High-Speed Atomic Force Microscopy:HS-AFM) で,核膜孔を観察しました(図)。このがん細胞に,臨床試験にも使用され,将来的な抗がん剤として期待されている薬剤Alisertib(MLN8237)を作用させると,核膜孔が狭く深くなることを明らかにしました。MLN8237は細胞死やオートファジー(※2)を引き起こすことが知られています。この核膜孔の変化は細胞死における核膜孔の機能低下,そしてがん細胞が不可逆的な死に至るコードであると考えられます。これらの知見は将来,核を標的としたナノドラッグデリバリーシステム(※3)の開発に活用されることが期待されます。
本研究成果は,2017年5月22日にアメリカ化学会誌「ACS Nano」のオンライン版に掲載され,今後発行される同誌冊子体にも掲載される予定です。
図.大腸がん細胞から核膜を生きたまま取り出し,HS-AFMにて観察する
核膜孔をHS-AFMによって観察することで,糸状になったタンパク質の複合体であるフェニルアラニン‐グリシン‐ヌクレオポリン(FG-Nups,※4)フィラメントの動きを撮影することに成功した。図は,FG-Nupsフィラメントを高速フーリエ変換(Fast Fourier Transform:FFT)‐バンドパスフィルター(特定の波長の光だけを効率よく透過するフィルター)を通して見たものとそのまま見たもの(オリジナル)。
※2 オートファジー
細胞が持つ細胞内のタンパク質を分解する仕組みの一つ。
※3 ナノドラッグデリバリーシステム
目標とする患部に薬物を効果的かつ集中的に送り込む投与システム。
※4 フェニルアラニン‐グリシン‐ヌクレオポリン
アミノ酸の一種であるフェニルアラニンとグリシンの繰り返し交配を持つ核膜孔複合構成タンパク質(ヌクレオポリン:Nups)。




 PAGE TOP
PAGE TOP