新学術創成研究機構革新的統合バイオ研究コア 高速バイオAFM応用研究ユニットの柴田幹大准教授らの研究グループは,東京大学の研究グループと共同で,理工研究域バイオAFM先端研究センターの安藤敏夫特任教授らが開発した世界最速の原子間力顕微鏡(高速AFM(※1))を用いて,ゲノム編集ツールCRISPR-Cas9(※2)がDNAを切断する一連の様子を動画として撮影することに成功しました。
近年,生命の設計図であるゲノム情報を書き換えるゲノム編集(※3)と呼ばれる技術が脚光を浴びており,細菌の持つDNA切断酵素CRISPR-Cas9を応用したゲノム編集技術が,基礎研究から臨床応用に至る多岐にわたる生命科学分野において広く利用されています。これまで,本研究グループや海外の研究グループによってCRISPR-Cas9の結晶構造が決定され,DNA切断メカニズムの理解が進められてきました。Cas9単体,Cas9がガイドRNAと結合した状態(Cas9-RNA複合体),Cas9がガイドRNAおよび標的DNAと結合した状態(Cas9-RNA-DNA複合体)の結晶構造の比較から,RNAやDNAの結合に伴い,Cas9は大きく構造を変化させることが示唆されていました(図1)。しかし,実際にCas9がどのような構造変化を起こすのかは,明らかになっていませんでした。
今回,本研究グループは,標的配列を1つだけ含むDNAとCas9-RNA複合体を混合し,高速AFM観察を行ったところ,Cas9-RNA複合体がDNAに衝突を繰り返しながら標的のDNAを見つけ出し,安定に結合する様子を明らかにしました(図2)。さらに,Cas9-RNA-DNA複合体を高速AFM観察している間に,切断反応に必要なマグネシウムイオンを添加したところ,HNHドメインがDNAの切断部位に移動したのち,切断されたDNAがCas9から離れる様子を撮影することに成功しました(図3)。今回撮影された高速AFM動画は,Cas9の動きをリアルスペースかつリアルタイムで可視化した画期的な研究成果といえます。
本研究結果によって得られた動的な構造情報は,CRISPR-Cas9によるDNA切断メカニズムの深い理解につながるとともに,より高効率・高精度なゲノム編集ツールの開発の基盤となることが期待されます。
本研究成果は,2017年11月10日に『Nature Communications』のオンライン版に掲載されました。
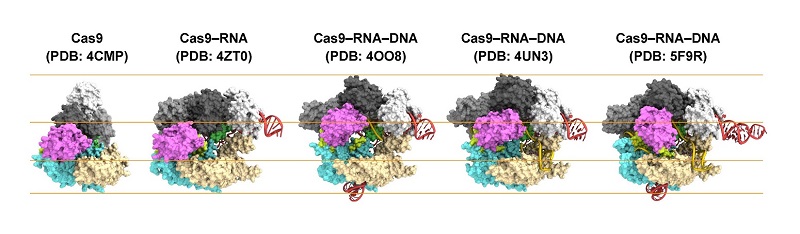
図1.CRISPR-Cas9の結晶構造

図2.Cas9-RNA複合体によるDNAの探索
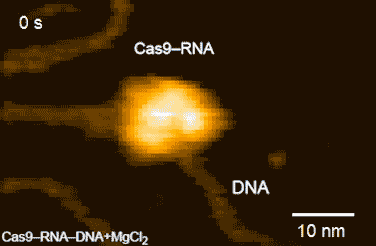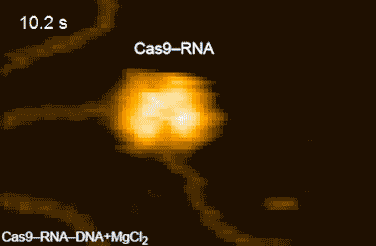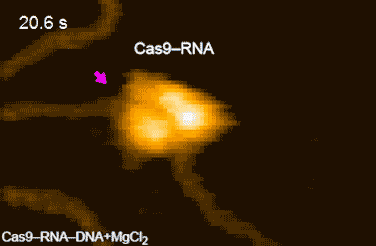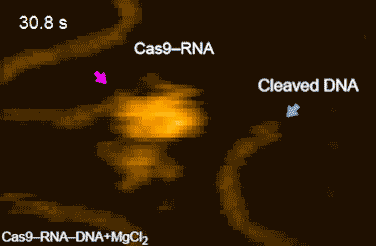
図3.Cas9-RNA複合体によるDNAの切断
DNAの切断部位に近い状態のHNHドメインをピンク色の矢印で示している。
【用語解説】
※1 高速AFM(高速原子間力顕微鏡)
柔らかい板バネの先に付いた針の先端で試料に触れ,試料の表面形状を可視化する顕微鏡。針と試料の水平方向の相対位置を変えながら試料表面の高さを計測することにより,試料の表面形状を可視化する。試料の表面を高速(最速33フレーム/秒)にスキャンすることで,試料の動きを可視化することができる。↑
※2 CRISPR-Cas9
微生物のもつ獲得免疫機構の一つ。CRISPR-Cas系において,Cas9はガイドRNAと結合し,ガイドRNAの一部(20塩基のガイド配列)と相補的なDNAを選択的に切断する。ガイド配列を変更することで,さまざまな塩基配列を持つDNAを選択的に切断することができる。↑
※3 ゲノム編集
生命の設計図であるゲノムDNAの塩基配列を改変する技術。CRISPR-Cas9を利用することで,より効率的なゲノム編集が可能になった。↑




 PAGE TOP
PAGE TOP