細胞内のゲノム情報を操作するためのツールとして注目される「ゲノム編集技術」は,基礎研究への利用はもちろんのこと,工業,農水産業,医療など,さまざまなライフサイエンス分野への社会実装が展開されています。
今回,金沢大学ナノ生命科学研究所の古寺哲幸教授,梅田健一特任助教らは,東京大学医科学研究所,理化学研究所との共同研究グループにおいて,これまでに国産ゲノム編集技術として開発してきたCRISPR-Cas3(※1)が狙ったゲノム配列を認識して二本鎖DNAを切断する仕組みを世界で初めて明らかにしました。従来広く使われているCRISPR-Cas9のハサミのように二本鎖DNAを同時に切る方法とは異なり,CRISPR-Cas3は二本鎖DNAをほどいて片方の鎖を手繰り寄せながら,一本鎖DNAをそれぞれ別々に切ることで,大きなDNA断片を切断していることを見出しました。また,こうした一連の反応を,金沢大学が世界にさきがけて開発してきた顕微鏡技術である高速原子間力顕微鏡(高速AFM)(※2)を用いて映像として撮影することに成功しました。
本研究成果によってCRISPR-Cas3の効率化や安全性の強化といった技術改良が容易になり,優れた国産ゲノム編集技術として新たな創薬や遺伝子治療などへの利用,農水産物の品種改良といった産業利用など,さまざまな分野への応用が進展することが期待されます。
本研究成果は,2022年8月30日(英国時間),国際科学雑誌『Nature Communications』オンライン版に掲載されました。
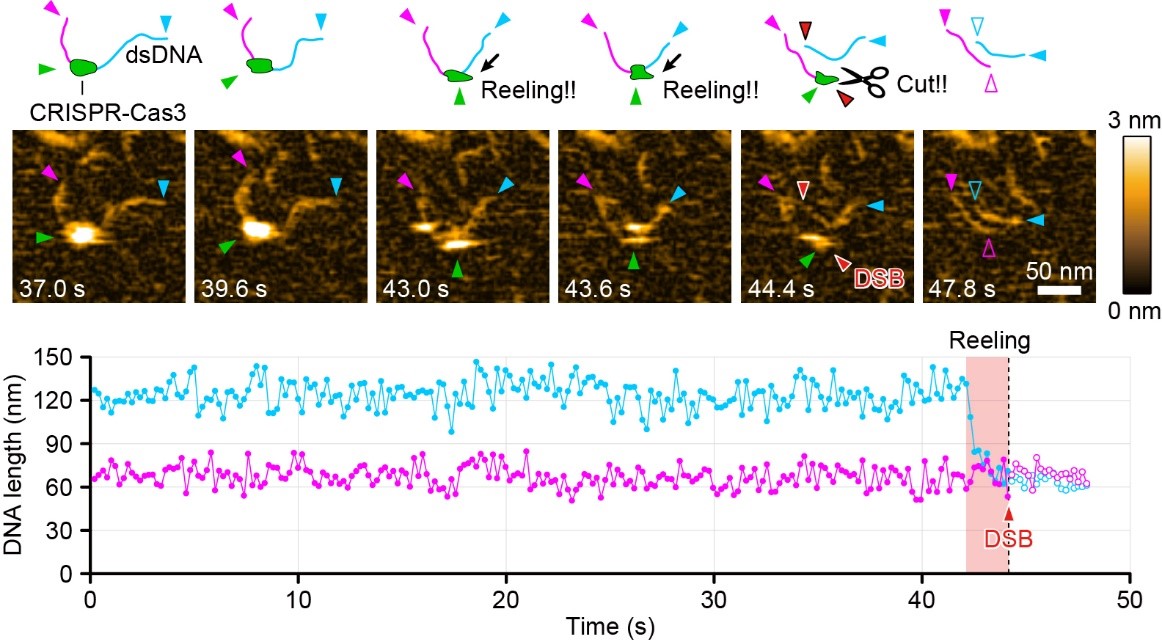
【参考図】CRISPR-Cas3が二本鎖DNAを切断する様子を捉えた高速AFM画像
標的部位に結合したCascade-Cas3複合体(緑色)が上流の長鎖側(青色)を巻き取り,短くなったときに二本鎖切断(赤色,DSB)が導入される様子がわかる。下のグラフはDNAの長さの経時変化を測定したもの。
【用語解説】
※1 CRISPR-Cas3
多くの細菌は,獲得性免疫に似た「CRISPR-Cas(クリスパー-キャス)システム」と呼ばれる防御システムを備えています。CRISPR-Cas3は, 細菌,古細菌が持つCRISPRシステムの中でクラス1に属するCRISPRシステムのことです。複数タンパク質の複合体でDNAを人工的に切断する国産ゲノム編集ツールとして,2019年に報告しました。
※2 高速原子間力顕微鏡(高速AFM)
板バネの先に付いた針の先端で試料に触れ,試料の表面形状を可視化する顕微鏡。針と試料の水平方向の相対位置を変えながら試料表面の高さを計測することにより,試料の表面形状を可視化します。試料の表面を高速にスキャンすることにより1分子レベルで試料の動きを映像化できます。
研究者情報: 古寺 哲幸




 PAGE TOP
PAGE TOP