ナノ生命科学研究所の華山力成教授,医薬保健研究域医学系・ナノ生命科学研究所の山野友義准教授,大学院医薬保健学総合研究科医学専攻博士後期課程4年の呂夏氷さんらの研究グループは,新型コロナウイルス(SARS-CoV-2)のスパイクタンパク質(※1)に対するナノボディー(※2)と抗ウイルス作用をもつサイトカインであるIFN-βを搭載した改変エクソソーム(※3)を作製し,培養実験でSARS-CoV-2シュードウイルス(※4)の細胞への感染を阻害すると同時に,細胞を抗ウイルス状態へと誘導することに成功しました。
新型コロナウイルスは,2019年12月以降,世界の公衆衛生を脅かしている一本鎖RNAウイルスです。新型コロナウイルスの感染は,SARS-CoV-2スパイクタンパク質が細胞上のアンジオテンシン変換酵素2(ACE2)に結合することで起こります。したがって,スパイクタンパク質を抗体でブロックしACE2に結合できなくすることは,SARS-CoV-2感染予防および重症化を防ぐための重要な戦略であり,抗スパイク中和抗体はCOVID-19の治療薬として使われています。またPfizer-BioNTech社およびModerna社が製造した新型コロナワクチンも,スパイクタンパク質に対する抗体産生を促します。一方で,新型コロナウイルスオミクロン株で見られるように,新型コロナワクチンの感染予防効果を下げるような株も出現してきており,抗スパイク中和抗体単独では新型コロナウイルスの感染および重症化を完全に防ぐことはできません。
本研究グループは,細胞に抗ウイルス状態を誘導するIFN-βと抗スパイクナノボディーを,エクソソームに結合する能力があるMFG-E8タンパク質と繋げた融合タンパク質を作製し,これを膜表面上に多数搭載した改変エクソソームを開発しました(図1)。SARS-CoV-2シュードウイルスを用いた培養実験では改変エクソソームを加えた群において顕著に感染阻害効果が見られました(図2)。さらに,感染細胞を取り出し,抗ウイルス免疫を誘導するIFN誘導遺伝子の発現を調べたところ,コントロールのエクソソームを加えた群ではほとんどIFN誘導遺伝子の発現は見られませんでしたが,改変エクソソームを加えた群においてはIFN誘導遺伝子の高い発現が認められました(図3)。これは改変エクソソームを加えることによって,IFN-βが感染細胞に選択的に届けられ,抗ウイルス状態が誘導されていることを示しています。
本研究により,抗スパイクナノボディーとIFN-βを発現させた改変エクソソームには感染阻害効果をもたらすと同時に,抗ウイルス免疫応答を誘導することが分かりました。この発見を受け,今後の研究によりCOVID-19の重症化を防ぐ新しい方法につながることが期待されます。また本技術は抗体を用いてサイトカインを選択的に届けることができ,今後改変エクソソームを用いた他の感染症の治療法や,がんに対する治療法へと研究が発展することが期待されます。
本研究成果は,2022年9月27日に国際科学誌『Pharmaceutical Research』のオンライン版に掲載されました。
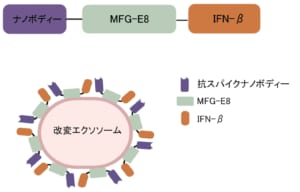
図1 改変エクソソームの模式図
MFG-E8はC1C2ドメインを介してエクソソーム上のホスファチジルセリン(PS)に結合する。この性質を利用してナノボディー,MFG-E8,IFN-βを繋げた融合タンパク質を作製し,それらを搭載した改変エクソソームを作製した。
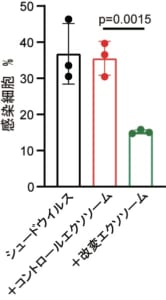
図2 改変エクソソームによるSARS-CoV-2ウイルスの感染阻害
ACE2発現細胞にウイルスを感染させる実験において,コントロールエクソソームを添加した場合と比較して,改変エクソソームを添加した場合では顕著にウイルス感染が抑えられている。
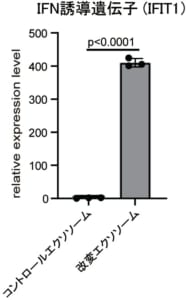
図3 改変エクソソームによるIFN誘導遺伝子の発現誘導
改変エクソソームは,ウイルス感染細胞においてIFN誘導遺伝子を発現させることにより,感染細胞を抗ウイルス状態へと誘導する。
【用語解説】
※1 スパイクタンパク質
新型コロナウイルスの表面にあるタンパク質で,ヒト細胞表面のアンジオテンシン変換酵素(ACE2)に結合することで細胞に感染する。
※2 ナノボディー
低分子化抗体の一種で重鎖のみからなる抗体。
※3 エクソソーム
細胞が分泌する脂質二重膜に覆われた小胞。分泌細胞由来のタンパク質やRNA,脂質などを含んでおり,さまざまな細胞間情報の伝達を担っている。改変エクソソームは人工的にエクソソームを改変したもの。
※4 シュードウイルス
ウイルスのエンベロープタンパク質を他のウイルスのエンベロープタンパク質に変えたもの。本研究ではレンチウイルスにSARS-CoV-2のスパイクタンパク質を発現したものを用いた。
研究者情報:華山 力成
研究者情報:山野 友義




 PAGE TOP
PAGE TOP