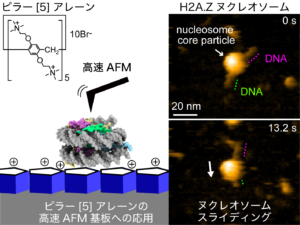
 大学院自然科学研究科数物科学専攻博士前期課程の森岡新さん,ナノ生命科学研究所/新学術創成研究機構の柴田幹大教授らの研究チームは,東京大学定量生命科学研究所の胡桃坂仁志教授らの研究グループおよび京都大学大学院工学研究科/ナノ生命科学研究所の生越友樹教授らの研究グループとの共同研究で,遺伝子発現制御に重要なヒストンタンパク質H2A.Zを含むヌクレオソーム(※1)が,わずか0.3秒の時間スケールでDNAに沿って移動する「ヌクレオソームスライディング」の様子を高速原子間力顕微鏡(高速AFM)(※2)を用いて世界で初めて撮影することに成功しました。
大学院自然科学研究科数物科学専攻博士前期課程の森岡新さん,ナノ生命科学研究所/新学術創成研究機構の柴田幹大教授らの研究チームは,東京大学定量生命科学研究所の胡桃坂仁志教授らの研究グループおよび京都大学大学院工学研究科/ナノ生命科学研究所の生越友樹教授らの研究グループとの共同研究で,遺伝子発現制御に重要なヒストンタンパク質H2A.Zを含むヌクレオソーム(※1)が,わずか0.3秒の時間スケールでDNAに沿って移動する「ヌクレオソームスライディング」の様子を高速原子間力顕微鏡(高速AFM)(※2)を用いて世界で初めて撮影することに成功しました。
真核生物では,ヒストンバリアント(※3)などのエピゲノム(※4)が,生命の本質ともいえる遺伝子発現の制御に重要な役割を担っています。ヒストンバリアントの一種であるH2A.Zは,遺伝子の転写活性領域と抑制領域の両方に高度に集積すること,また,その遺伝子欠損マウスが,ほとんどが生存できないという実験事実から,生体内で非常に重要な役割をもつことが知られています。しかしながら,H2A.Zが遺伝子発現の制御に活性(プラス)にも抑制(マイナス)にもはたらく,その分子メカニズムはほとんど分かっていませんでした。そこで本研究では,精製したH2A.ZとDNAをもとに,H2A.Zを含むヌクレオソームを試験管内で再構成し,その1秒以下のナノ動態を高速AFMを用いて直接可視化することを試みました。その結果,H2A.Zを含むヌクレオソームが,自発的に0.3秒以内の時間スケールでDNAに沿って移動すること(ヌクレオソームスライディング)を発見しました。さらに,H2A.Zのアミノ酸残基を主要型であるH2Aのアミノ酸残基へ入れ替えた変異体を解析することにより,H2A.ZのN末端に位置するアミノ酸残基がこのヌクレオソームスライディングに関与していることを明らかにしました。
今回の研究では,ヌクレオソームのダイナミクス観察という観点において,エピゲノムによる遺伝子発現制御の分子メカニズムの一端を明らかにしました。この高速AFMによるヌクレオソームのナノ動態観察は,今後,遺伝子発現制御の分子メカニズムに対して新しい知見を提供することが期待されます。
本研究成果は,2023年2月13日(米国東部時間)に国際学術誌『Nano Letters』にオンライン掲載されました。
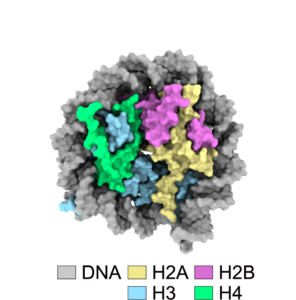
図1:ヌクレオソーム構造
ヌクレオソームはヒストンH2A-H2B二量体2つとH3-H4二量体2つからなるヒストン八量体にDNAが巻き付いた複合体です。
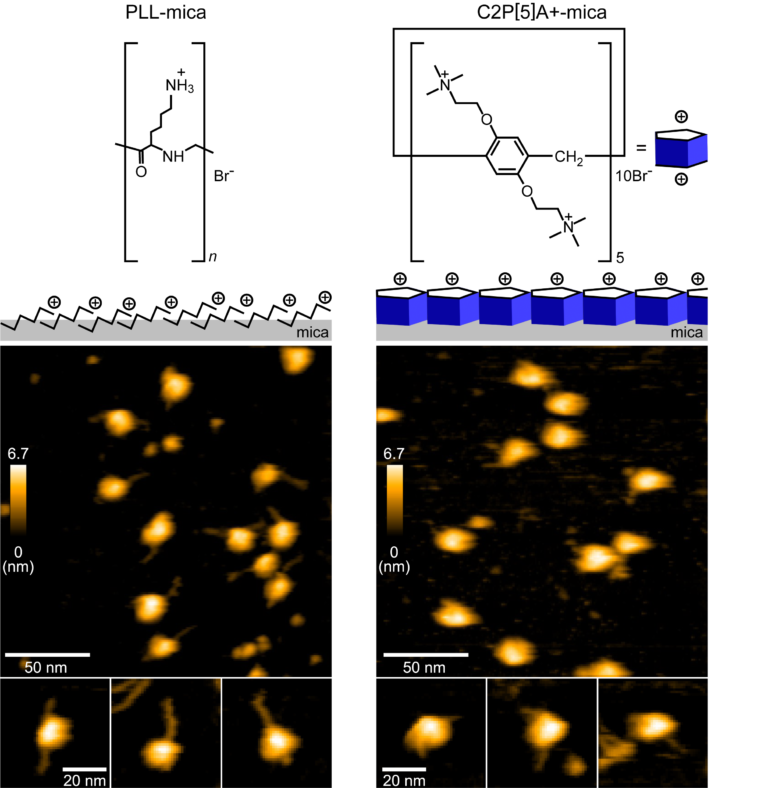
図2:従来のAFM基板(PLL, 左図)と今回用いたAFM基板(C2P[5]A+, 右図)の比較
従来用いられていたAFM基板を使ってヌクレオソームの観察をしたところ,DNAが基板に強く結合し,DNAがヌクレオソームから剥がれた構造が観察されました。一方,ピラー[5]アレーンをAFM基板に用いた場合,DNAが剥がれた様子は観察されませんでした。

図3:高速AFMで観察したヌクレオソームスライディング
(上図)主要型H2Aを含むヌクレオソームの連続した高速AFM画像。(下図)H2A.Zを含むヌクレオソームの連続した高速AFM画像。1フレーム0.3秒で撮影。高速AFMの映像から,H2A.Zヌクレオソームの球状(ヒストン八量体)の部分が,ひも状に見えるDNA上に沿って自発的にスライディングをすることが明らかとなりました。原著論文では,このスライディング現象を動画で見ることができます。
【用語解説】
※1:ヌクレオソーム
クロマチン(染色体)の基本構成単位で,H2A, H2B, H3, H4の4種類がそれぞれ2分子ずつ,計8個のヒストンタンパク質が結合し,その周囲にDNAが巻きついたものを指す。ヒストンが「糸巻き」のような役割を持つことによって,非常に長い鎖状のDNAが,クロマチンの内部にコンパクトに収納される。
※2:高速原子間力顕微鏡(高速AFM)
試料の表面をナノメートルの直径をもつ探針でなぞることで,試料の表面形状を可視化する顕微鏡。溶液中にある生体分子を,ナノメートルの空間分解能と高い時間分解能(最速33フレーム/秒)でスキャンすることにより,試料の構造と動きの両方を可視化することができる。
※3:ヒストンバリアント
主要型ヒストンとアミノ酸配列の異なる,ヒストンの亜種。主要型ヒストンに代わりヌクレオソームに取り込まれることでクロマチン構造が変化し,それにより転写やDNAの複製・修復などの機能が制御される。
※4:エピゲノム
DNAの塩基配列を変えることなく,遺伝子のはたらきを決める仕組み。ゲノムDNA中の遺伝子がRNAに転写される度合いを制御する。
※5:ピラーアレーン
正多角柱の管状分子。特に,ピラー[5]アレーンは,正5角柱の環状分子で,マイカ表面に単分子層を形成する。
研究者情報:柴田幹大




 PAGE TOP
PAGE TOP