金沢大学ナノ生命科学研究所(WPI-NanoLSI)/名古屋大学大学院工学研究科の高橋康史教授,WPI-NanoLSI の華山力成教授,福間剛士教授,および海外主任研究者(PI)で英国・インペリアル・カレッジ・ロンドンのユリ・コルチェフ教授らの共同研究グループは,生細胞表面の構造をナノスケールのレベルで可視化する技術を確立し,細胞外物質の取り込み過程や,細胞間コミュニケーションに関与するエクソソーム(※1)の可視化に成功しました。
ウィルスの細胞内への侵入や,細胞内外との物質のやり取りを観察するためには,現状の顕微鏡技術の空間分解能では不十分です。そのため,超解像度顕微鏡(※2)など高分解能化が進められていますが,依然として空間分解能に課題を抱えています。細胞を生きたまま直接可視化するライブセルイメージングは,細胞のダイナミックな動きを理解することのできる方法です。走査型イオンコンダクタンス顕微鏡(SICM)(※3)は,細胞のナノ構造を侵襲することなく生きた状態でライブイメージングを行うことができます。しかしながら,SICM の解像度向上に不可欠なガラスナノピペット(※4)の微細化が困難なため,これまではその高度な技術を持つ限られた研究グループのみが超解像度のイメージングを達成してきました。本研究では,このような細胞表面のナノスケールの構造変化を再現性良く観察するため,キーとなる微細なガラスナノピペットの作製法を確立しました。さらに,高解像度 SICM により,細胞外の物質を取り込む過程の1つであるエンドサイトーシスを連続的に可視化することや,細胞外へ放出されるエクソソームの動きを捉えることに成功しました。
本研究成果は,2023 年 8 月 20 日付(米国東部時間)でアメリカ化学雑誌『Analytical Chemistry』のオンライン版に掲載されました。
【本研究のポイント】
- 生きた細胞のダイナミックな構造変化をナノスケールで可視化。
- イメージングの再現性を大幅に向上させるプローブ作製方法を確立。
- 細胞外物質の取り込み過程を可視化。
- 細胞が放出したエクソソームを直接可視化。
- 細胞間コミュニケーションの理解への貢献が期待。
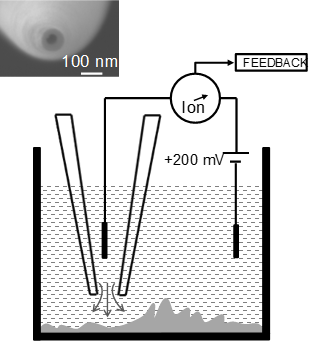
図1:走査型イオンコンダクタンス顕微鏡(SICM)の計測原理図
ナノピペットと試料の存在する溶液に配置した2本のAg/AgCl電極の間に一定の電圧を加え,その際に生じるイオン流に起因したイオン電流を利用して,ナノピペットと試料との距離を制御し,高さ情報を取得します。XY方向に走査しながらこの計測を行うことで,形状イメージを取得することができます。
【用語解説】
※1:エクソソーム
細胞から分泌される直径 50-150 ナノメートル(nm:10 億分の 1 メートル)の顆粒状の物質。その表面は細胞膜由来の脂質,タンパク質を含み,内部には核酸(マイクロ RNA,メッセンジャーRNA,DNA など)やタンパク質など細胞内の物質を含む。
※2:超解像度顕微鏡
蛍光分子の特徴を巧みに利用することで,回折限界を超えた高い空間分解能を達成する手法。時空間分解能はトレードオフであり,さまざまな手法が開発されている。
※3:走査型イオンコンダクタンス顕微鏡(SICM)
ガラスナノピペットをプローブに用いて,溶液中でイオン電流をフィードバックシグナルとして利用し,ガラスナノピペットと試料との距離を制御しながら,試料表面の形状を計測する手法。
※4:ガラスナノピペット
ガラスキャピラリー(毛細管)を,専用の伸長装置を使って,加熱しながら引っ張ることで作製した尖った先端部にナノスケールの開口を有する中空のガラスピペット。
ジャーナル名:Analytical Chemistry
研究者情報:高橋 康史




 PAGE TOP
PAGE TOP