金沢大学新学術創成研究機構ナノ生命科学研究所の安藤敏夫特任教授は,名古屋大学,米国のバンダービルト大学およびスプリングヒル大学と共同で,高速原子間力顕微鏡(高速AFM)(※1)と計算機シミュレーションを用いて,シアノバクテリア(※2)の時計タンパク質の概日リズム(※3)を安定化するメカニズムを世界で初めて解明しました。
シアノバクテリアの概日時計はKaiA, KaiB, KaiCと呼ばれるタンパク質からなり,KaiCの自己リン酸化の程度が約24時間のリズムを刻みます。本共同研究では,数日にわたって細胞内で持続するKaiCのリン酸化の約24時間周期の振動を試験管内で再現しました。その結果,KaiAがKaiCに短時間で頻繁に相互作用し,それによりKaiCの自己リン酸化活性が増大するとともに,そのリン酸化の増大につれてKaiAのKaiCへの親和性が低下していく様子が観察されました。すなわち,KaiCのリン酸化状態がKaiAの結合イベントにフィードバックされることが分かりました。
この頻繁に起こる短時間の結合・解離が長時間の振動周期を決定するだけでなく,KaiAとKaiCの親和性の変化はノイズのある細胞内環境での概日振動に安定性を与えることが見出されました。
本研究成果は,2018年8月14日(英国時間)に英国科学誌「Nature Communications」のオンライン版に掲載されました。
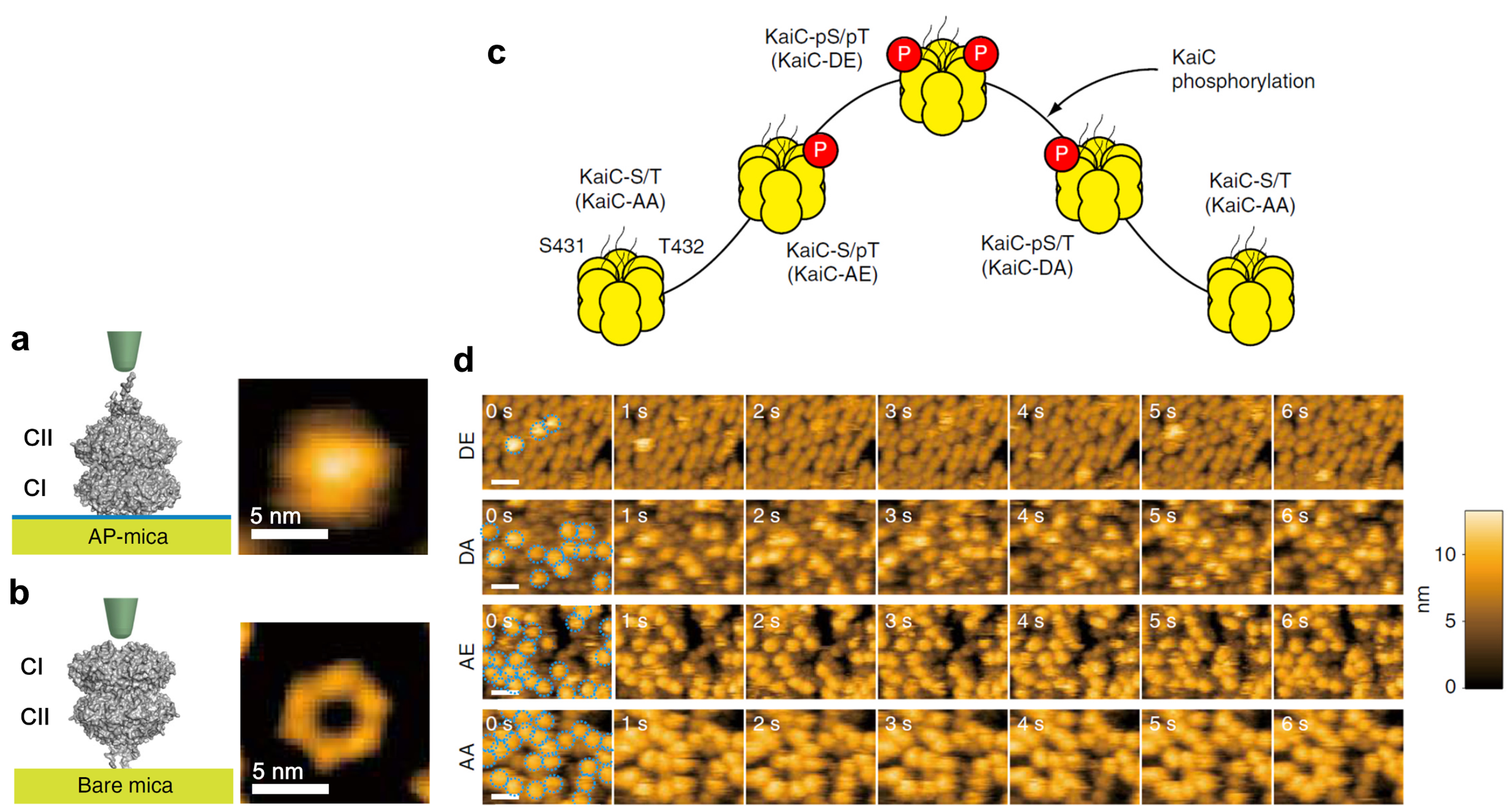
図1.
基板に載せたKaiCの模式図と高速AFM像(a,b),KaiCのリン酸化状態の概日リズム(c)とそれに依存したKaiAのKaiCへの結合の高速AFM像(d)
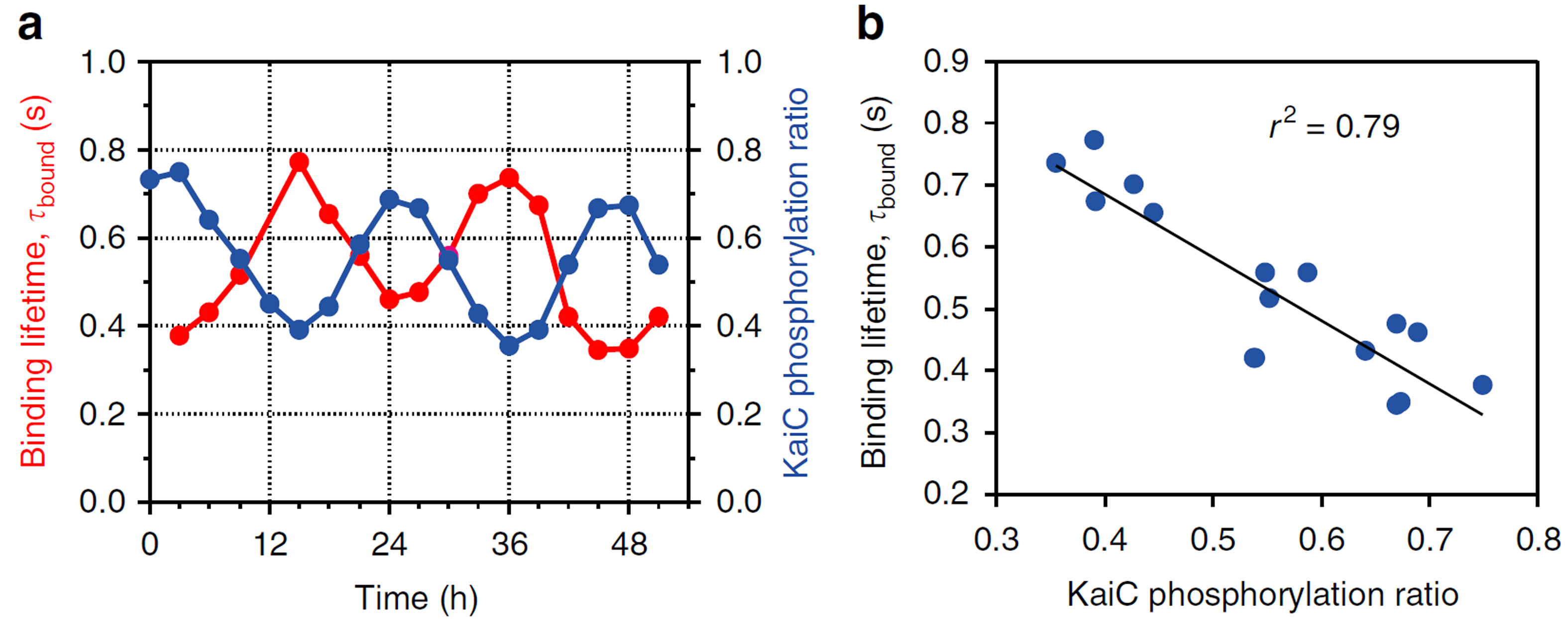
図2.野生型のKaiCのリン酸化の程度に同期して変動するKaiAの結合寿命
(a) 51時間に亘るKaiABCシステムにおけるKaiCのリン酸化の割合とKaiAの結合寿命の経時変化。
(b) KaiCのリン酸化の程度とKaiAの結合寿命の相関。
【用語解説】
※1 高速原子間力顕微鏡(高速AFM)
非常に微細な先端を持つ探針で試料表面を高速に走査し,高さの変化として個々のタンパク質の構造変化を実時間で観察する手法。
※2 シアノバクテリア
植物と同じように光合成を行い,生化学的なペースメーカー(生物時計)を持つ細菌の一種。
※3 概日リズム
生体に内在する生物時計により制御される約24時間の振動を示す生物学的な一連の変化。これらの変化は遺伝子発現,代謝,細胞分裂から発達,行動にまで及ぶとともに,細胞内の成分が変動しても概日リズムは安定に保たれる。
・ 詳しくはこちら
・ 研究者情報:安藤 敏夫




 PAGE TOP
PAGE TOP