がん進展制御研究所/ナノ生命科学研究所の酒井克也准教授,がん進展制御研究所/ナノ生命科学研究所/新学術創成研究機構の松本邦夫教授らは,大阪大学蛋白質研究所の高木淳一教授,東京大学大学院理学系研究科の菅裕明教授らとの共同研究グループにおいて,環状ペプチドとタンパク質工学の融合技術によって, 有効血中濃度が数週間保たれる人工成長因子や, 末梢から投与しても脳内に到達する人工成長因子の創成に成功しました。
インスリンなどの細胞成長因子は微量でも優れた生理活性を発揮するタンパク質で医薬品として利用されていますが,一般に血中半減期が短く,脳内の神経に到達できないため,慢性疾患や中枢神経疾患の治療に利用することは困難でした。本研究グループは,細胞成長因子受容体に結合する環状ペプチドの活性配列を,血中に長期に維持される抗体Fc分子内や,脳内移行性をもつ抗体分子内に内挿することによって,有効濃度が長期に維持される人工成長因子や脳内移行性を持つ人工成長因子を開発しました。
この方法によって,細胞成長因子の優れた生理活性が肝硬変などの慢性疾患やパーキンソン病などの中枢神経疾患の治療に活用されることが期待されます。
本研究成果は,2022年11月7日午後4時(英国時間)に英国科学誌『Nature Biomedical Engineering』のオンライン版に掲載されました。
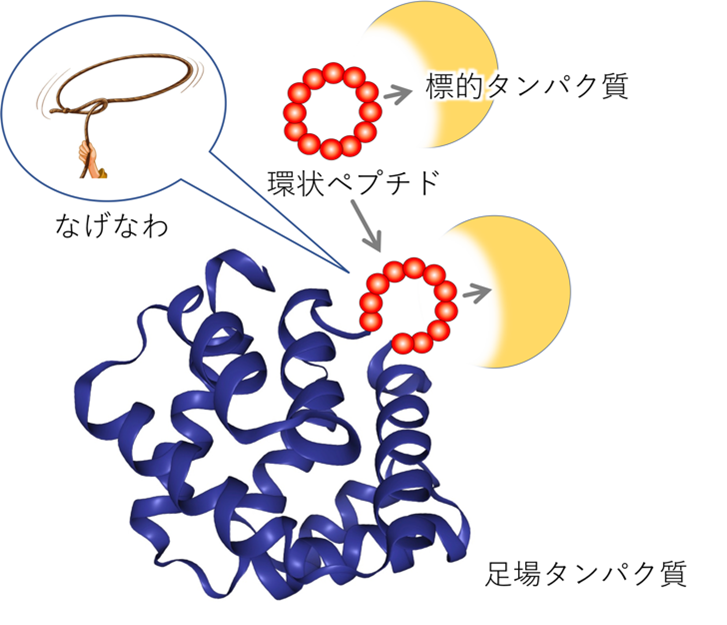
図1:ラッソ・グラフト法
医薬標的タンパク質に結合する環状ペプチドの活性配列を,投げ縄(Lasso)状にタンパク質の表面のループ構造の中に埋め込むことで,環状ペプチドの機能と足場タンパク質の機能を併せ持つ分子を創成する。
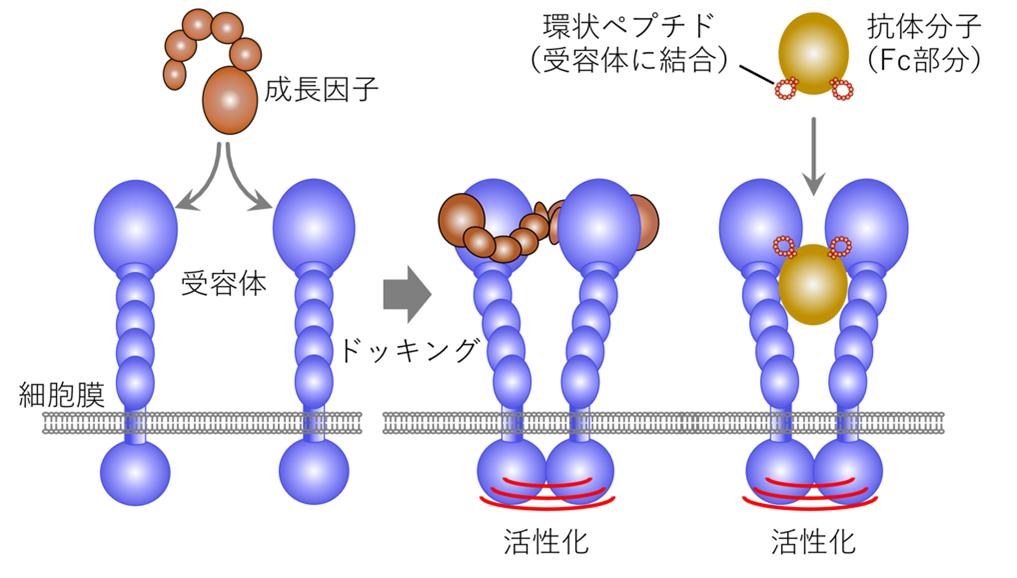
図2:成長因子受容体の活性化
2つの受容体がドッキングすることでお互いを活性化する。受容体に結合する環状ペプチドを2つ提示した抗体Fc分子は,受容体のドッキングを促し活性化すると予想された。
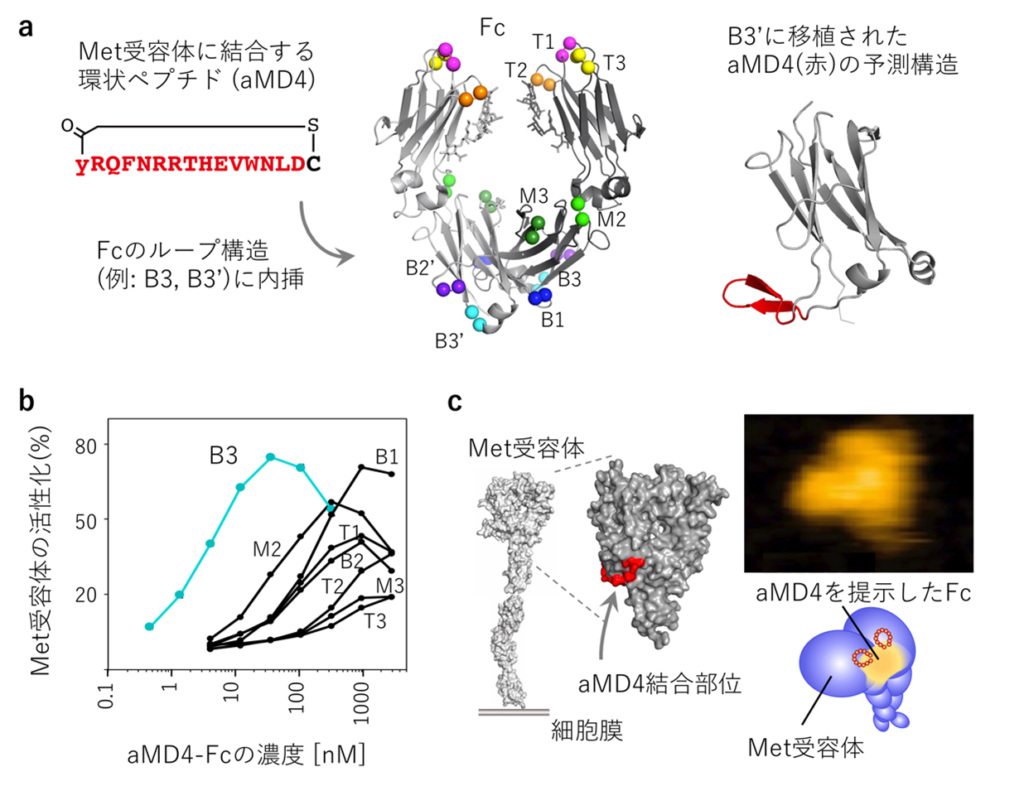
図3:Met受容体を活性化する人工成長因子の創成
(a) Fcのループ構造(T1〜B3)の1組ずつにMet受容体結合環状ペプチドaMD4を内挿した。(b) 人工成長因子Fc(aMD4)B3は細胞上のMet受容体を活性化する。aMD4についてはB3ループへの内挿が最も活性が高い。(c) 人工成長因子Fc(aMD4)B3は2分子のMet受容体をドッキングする。右写真は高速原子間力顕微鏡(高速AFM)による観察。
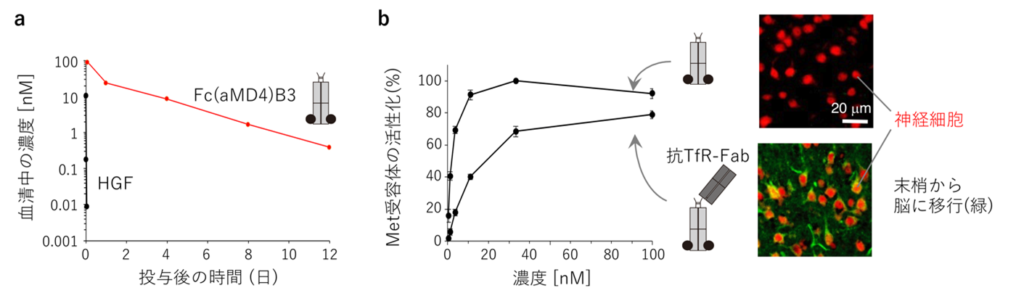
図4:長期血中動態と脳内移行性を持つ人工成長因子
(a) Met本来のリガンドHGFは血中半減期が非常に短いが,Fcに基づく人工成長因子Fc(aMD4)B3は血中半減期が長い。(b) 抗トランスフェリン受容体(TfR)抗体に基づく人工成長因子は,末梢に投与した1日後に脳内の神経細胞(赤)に届いている(緑)。
プレスリリースはコチラ
研究者情報: 酒井 克也
研究者情報: 松本 邦夫




 PAGE TOP
PAGE TOP