金沢大学がん進展制御研究所(新学術創成研究機構)笠原敦子助教のグループは,治療耐性肺がん細胞のミトコンドリアの形態制御因子を標的とすることで,治療感受性を取り戻すことを発見しました。本研究成果は,イタリア・パドヴァ大学Luca Scorrano教授,ナノ生命科学研究所/がん進展制研究所平尾敦教授,がん進展制御研究所河野晋助教,高橋智聡教授,後藤典子教授らとの共同研究によるものです。
肺がんは主要五大がんのひとつで,高い致死率を示す疾患です。肺がんの大部分を占める非小細胞肺がんの10-15%に上皮成長因子受容体 (EGFR) の変異が認められ,この遺伝子変異が発がんの原因となることが知られています。そのため,分子標的薬であるEFGR阻害剤が開発され,多くの患者に福音をもたらしてきました。一方,その治療耐性が深刻な問題として浮き彫りとなり,第二,第三世代のEGFR阻害剤が開発されてきましたが,未だに治療耐性の問題は解決されておらず,新しい治療戦略が待望されています。
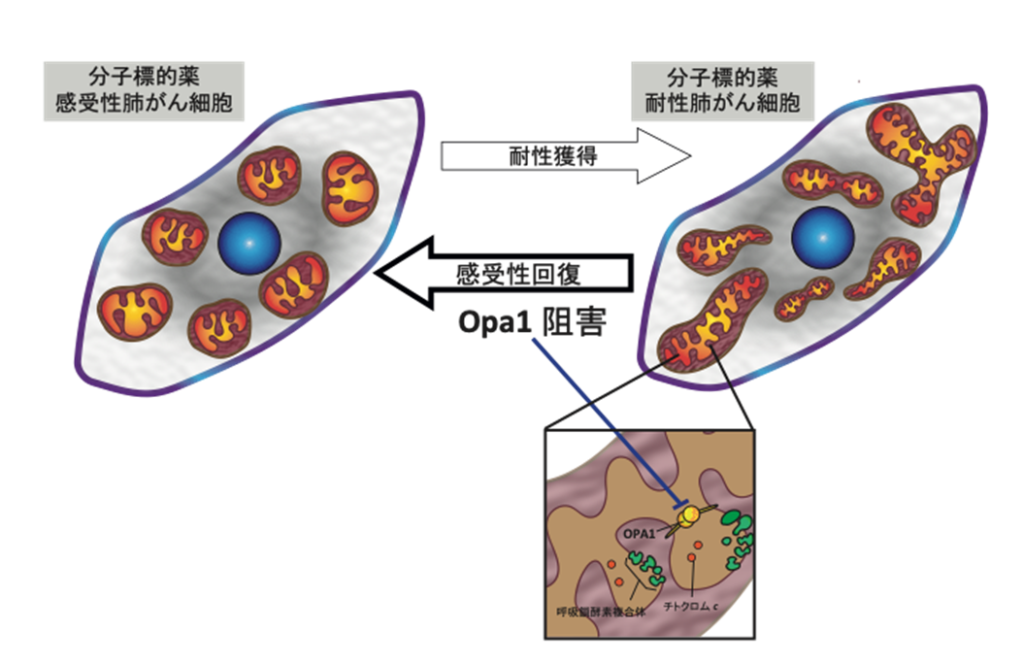
本研究では,肺がんの治療耐性においてミトコンドリアの形態制御因子が重要な役割を果たしていることを明らかにしました。治療耐性肺がん細胞ではエネルギー産生(※1)が顕著に上昇していること,またそれは,ミトコンドリアの形態制御因子であるOpa1(※タンパク質に起因することを見いだしました。
Opa1はミトコンドリア内膜を融合し,ミトコンドリアのエネルギー産生に必要な酵素群が埋まる内膜のクリステ構造(※3)を制御するタンパク質です。今回,抗がん剤治療を経た患者のOpa1発現が高い集団は予後不良であること,また,治療耐性肺がん細胞では,このOpa1のタンパク質発現が著しく上昇していることを見いだしました。そこで,共同研究者であるScorrano教授の研究室で同定された,Opa1特異的阻害剤とEFGR阻害剤ゲフィチニブとの併用が,新しい治療法として有効であることを明らかにすることができました。エネルギー産生細胞小器官であるミトコンドリアの動態制御を標的にすることは,多様な手段で生存を探る悪性がん細胞との戦いに有用であることが期待されます。
本研究成果は,2023年4月5日(英国時間)に国際学術誌『Cell Death and Disease』のオンライン版に掲載されました。
【用語解説】
※1 エネルギー産生
細胞のエネルギー(ATP)産生は,主に細胞質での解糖系と,ミトコンドリアマトリクスでのTCA回路とミトコンドリア内膜の呼吸鎖酵素複合体による電子伝達によって行われている。呼吸鎖酵素複合体の超構造形成には,クリステ構造が関与し,効率の良い電子伝達を制御している。
※2 OPA1 (Optic Atrophy 1)
ミトコンドリアの内膜融合因子で,またクリステ構造の根本に局在し,クリステ構造を調節するため,アポトーシス時のチトクロムc放出や,呼吸鎖酵素複合体の超構造形成とその機能効率に関わるタンパク質。
※3 クリステ構造
ミトコンドリア内膜のマトリクス側に貫入した層状の膜構造。突き出た先端にはATP合成酵素が局在し,根本にはOPA1が局在し,その構造を制御している。
ジャーナル名:Cell Death and Disease
研究者情報:笠原 敦子




 PAGE TOP
PAGE TOP