金沢大学ナノ生命科学研究所 (WPI-NanoLSI) の逢坂直樹特任助教,秋根茂久教授,ナノ生命科学研究所 (WPI-NanoLSI) の海外 PI で,カナダ・ブリティッシュコロンビア大学のマーク・マクラクラン教授の共同研究グループは,片手型のアミノ酸を一切含まないペプチドを用いて,一方向巻きの α-ヘリックス(※1)構造を構築することに,世界で初めて成功しました。
ペプチドやタンパク質が折り畳まれて形成する構造モチーフの代表例に,α-ヘリックスと呼ばれるらせん構造が挙げられます。天然のペプチドやタンパク質は,左手型のアミノ酸から構成されていて,結果として右巻きの α-ヘリックス構造をとります。しかし,片手型のアミノ酸を含まない α-ヘリックスは,右巻きと左巻きが溶液中で 1 秒間に数千から数万回の速さで互いに入れ替わり,両者が同量の混合物となります。そのため,このようなペプチドから右巻きと左巻きの α-ヘリックスを分離して取り出すことは不可能と考えられてきました。本研究では,このような α-ヘリックスの側面を「ステープル分子」で二重に「ホチキス留め」することで,この反転を約 1 兆倍も遅くして事実上止めることに成功しました。この「ホチキス留め」の方法により,片手型のアミノ酸を一切含まないペプチドの一方向巻きの α-ヘリックスを取り出すことにも成功しました。
これらの知見は将来,安定な α-ヘリックス構造が必要なペプチド医薬品の開発や,α-ヘリックス構造の本質のより深い理解に活用されることが期待されます。
本研究成果は,2023 年 10 月 26 日(英国時間)に英国科学誌『Nature Communications』のオンライン版に掲載されました。
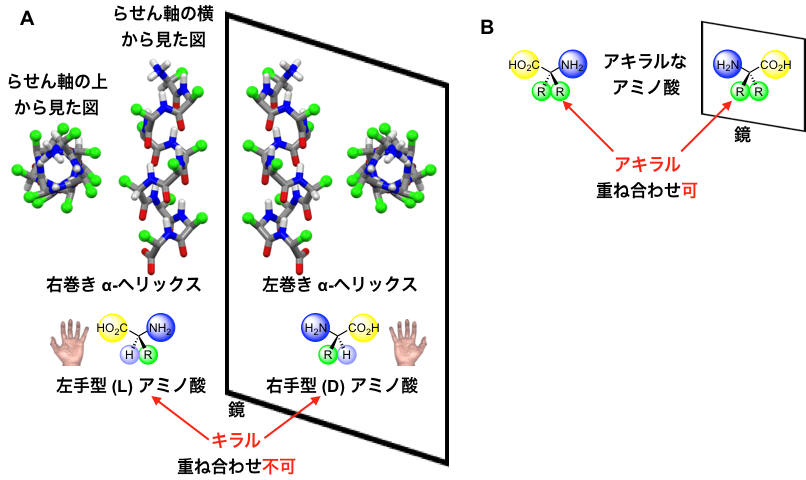
図1.A:左手型(L)アミノ酸からなる右巻き α-ヘリックスと,その鏡像の関係にある右手型(D)アミノ酸からなる左巻き α-ヘリックス。左手型(L)とその鏡像の右手型(D)のアミノ酸は重ね合わせることができないので,キラルなアミノ酸である。B:鏡に映した自身と重ね合わせることができる片手型を持たないアキラルなアミノ酸。
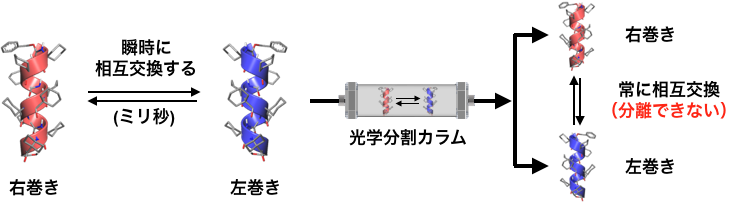
図2: アキラルなアミノ酸からなる α-ヘリックスは,右巻きと左巻きらせんが素早く相互交換する。光学分割カラムを通っている間も常に相互交換してしまうため,右巻きと左巻きを分離することができない。
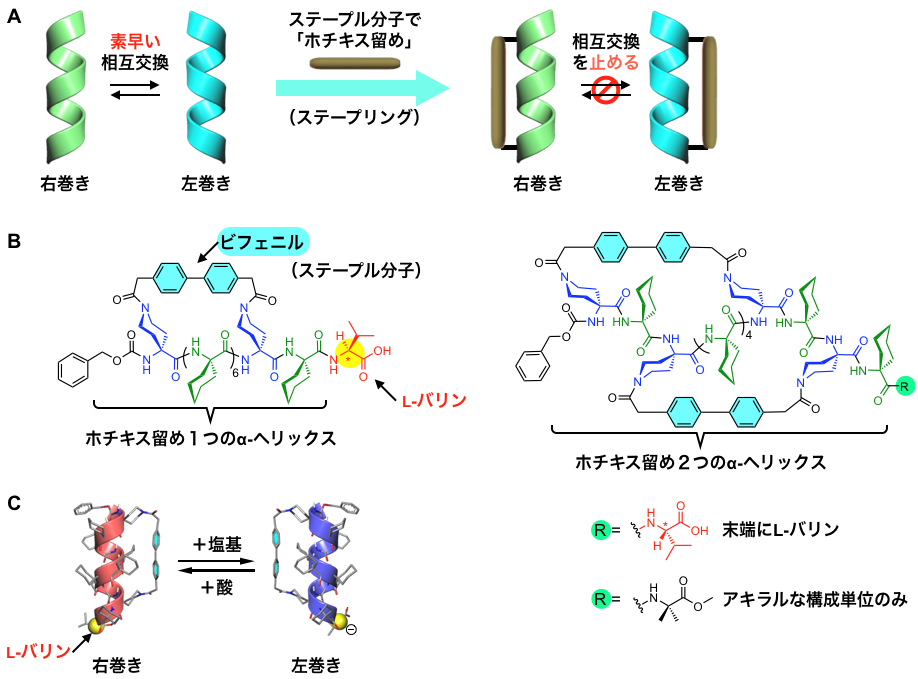
図3. A:ステープル分子によるα-ヘリックスの「ホチキス留め」。これによりらせんの反転を遅くして止めることを目指す。B:「ホチキス留め」を1つおよび2つ導入した α-ヘリックスの分子構造。ステープル分子としてビフェニル骨格を用いた。C:末端にL-バリンを導入した α-ヘリックスの右巻きと左巻きの変換。「ホチキス留め」を1つ持つ α-ヘリックスの場合,酸と塩基の添加により,数分の時間尺度で可逆的に右巻きと左巻きが入れ替わる。
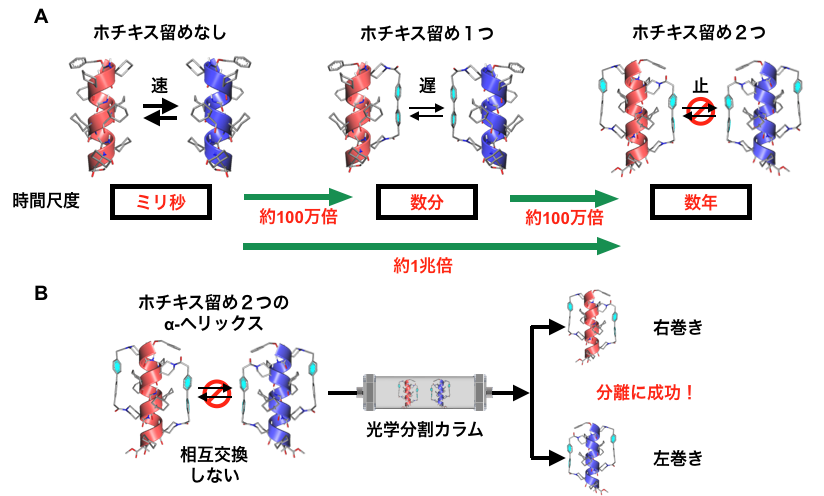
図4. A:「ホチキス留め」の数とらせん反転速度の関係。「ホチキス留め」1 つにつき相互交換の時間尺度が 1,000,000 倍長くなる。B:α-ヘリックスに「ホチキス留め」を 2 つ導入すると,右巻きと左巻きの相互交換が事実上起こらなくなる。その結果,光学分割カラムを用いて右巻きと左巻きを分離でき,片手型のアミノ酸を持たないペプチドの一方向巻きの α-ヘリックスを初めて取り出すことに成功した。
【用語解説】
※1:α-ヘリックス
ペプチドやタンパク質の二次構造モチーフの1つ。バネのようならせんの形をしており,アミノ酸3.6残基ごとにペプチド鎖が1回転する。
ジャーナル名:Nature Communications
研究者情報:秋根 茂久




 PAGE TOP
PAGE TOP