金沢大学ナノ生命科学研究所(WPI-NanoLSI)の紺野宏記准教授,ホルガー・フレクシグ特任助教,金沢大学大学院自然科学研究科生命理工学専攻博士前期課程の武田春冴さん,金沢大学大学院自然科学研究科自然システム学専攻博士前期課程の室郁弥さん(研究当時)らの研究グループは,細胞内で営まれるほぼ全ての生命現象の制御を行うユビキチン化(※1)に関与している酵素の構造動態や,各種ユビキチン化関連酵素間で行われるユビキチン受け渡しの様子を,高速原子間力顕微鏡(高速 AFM)(※2)を用いて,世界で初めて映像化することに成功しました。
タンパク質の翻訳後修飾の一つであるユビキチン化は,細胞内タンパク質の選択的分解,DNA 修復,細胞周期,シグナル伝達,免疫など,多くの細胞内プロセスの制御に関与しています。そのため,ユビキチン化に関連した細胞機能調節システムの全貌解明は,基礎生物学的な観点だけでなく,医療への応用においても極めて重要です。ユビキチン化は,複数のユビキチン化関連酵素間でユビキチンを受け渡しながら進行します。これらの酵素の中で,ユビキチン連結酵素(E3)は,ユビキチン化すべき標的タンパク質に最終的にユビキチンを受け渡す酵素です。この E3 に存在する,特定の構造を持たずふらふらと動く柔軟領域(ヒンジループ)を介した大きな構造変化が,ユビキチン受け渡しに必要であることがこれまで推測されていました。しかし,この構造動態を実際に観察した例がないため,長い間実証されていませんでした。今回の研究では,生体試料の形状と動きを同時に映像化できる高速 AFM を用いて,E3 の一つである E6AP(※3)の部分構造体である HECT ドメイン(※4)の構造動態をリアルタイムで映像化しました。さらに,コンピューターシミュレーションによる解析結果も加え,E3 の構造ダイナミクスや,その構造ダイナミクスにおけるヒンジプールの役割を詳細に理解することができました。これらの結果は,今後,ユビキチン化を通じたさまざまな細胞内プロセスの制御メカニズムに対して新しい知見を提供することが期待されます。
本研究成果は,2023 年 12 月 6 日(米国東部時間)に国際学術誌『Nano Letters』のオンライン版に掲載されました。
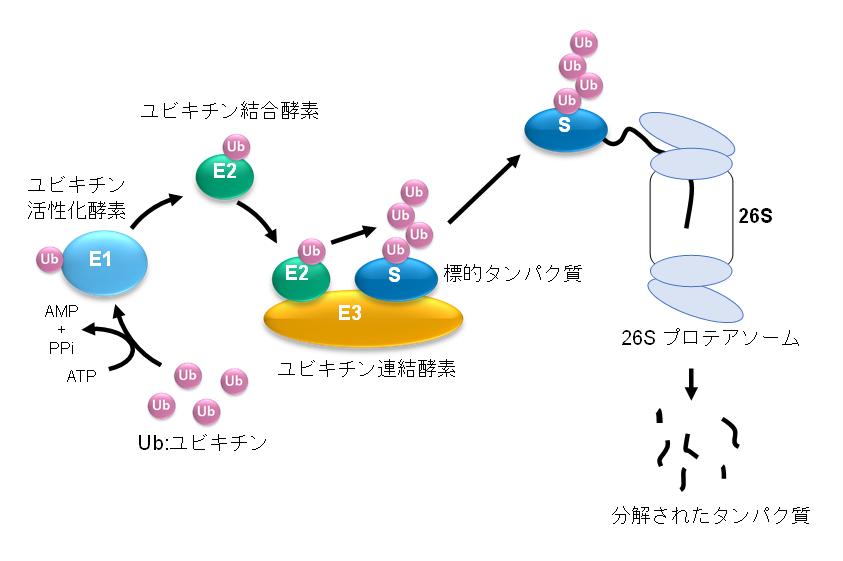
図1:タンパク質のユビキチン化およびユビキチン–プロテアソーム系によるタンパク質分解
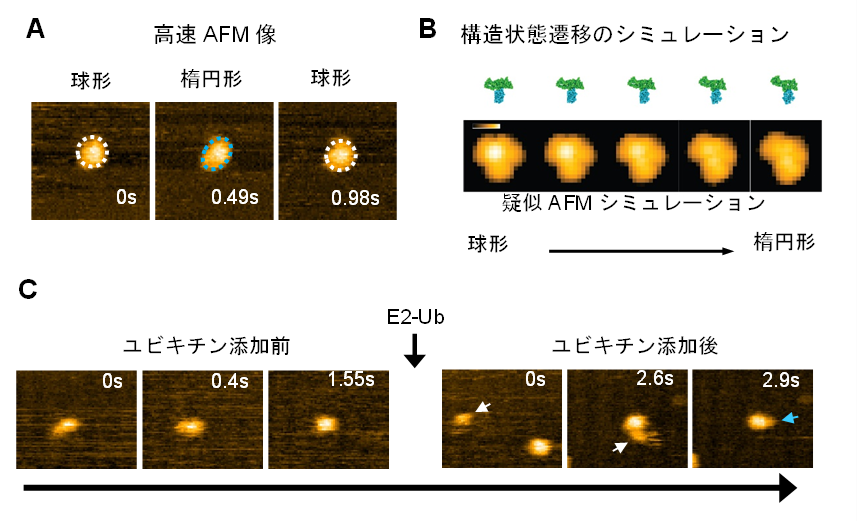
図2:E6APのHECTドメインの構造動態の高速AFM観察およびシミュレーション
(A)HECTドメインの高速AFM像。球形(白点線)と楕円形(青点線)の構造状態を繰り返す様子が観察された。(B)シミュレーションによるHECTドメインの構造状態の遷移過程およびその際の疑似AFM像。(C)E2からE3(HECTドメイン)にユビキチン(Ub)が受け渡される様子。ユビキチンを保持したE2(E2-Ub)を添加後,E2-Ub(白矢印)がHECTドメインに結合し,E2が解離した後はHECTドメインにユビキチンと思われる小さい粒子(青矢印)が付加していた。
【用語解説】
※1:ユビキチン化
ユビキチンは,76残基のアミノ酸からなるタンパク質で,すべての真核細胞に存在している。タンパク質の翻訳後修飾の一つであるユビキチン化は,ユビキチン化関連酵素(E1,E2,E3)の働きによりユビキチン1分子もしくはユビキチンが複数連結したユビキチン鎖が標的タンパク質に結合し,標的タンパク質の機能を制御する。
※2:高速原子間力顕微鏡(高速AFM)
原子間力顕微鏡(Atomic Force Microscopy: AFM)は,探針と試料の間にはたらく原子間力を基に,分子の形状をナノメートル(10-9m)程度の高い空間分解能で可視化する顕微鏡。高速AFMは,金沢大学の安藤敏夫特別功績教授のグループによって開発された超高速で観察できるAFMで,サブ秒(~0.1秒)という時間分解能でタンパク質などの生体分子の形状や動態を観察することできる。
※3:E6AP(E6-associated protein)
ユビキチン連結酵素(E3)の一つ。この酵素の機能異常が,子宮頸がんや重い知的障害やてんかんなどの特徴を示すエンジェルマン症候群に関与していることが知られている。
※4:HECTドメイン
すべてのHECT型E3に共通して保存されている部分構造。
ジャーナル名:Nano Letters
研究者情報:紺野 宏記




 PAGE TOP
PAGE TOP