金沢大学大学院自然科学研究科数物科学専攻博士前期課程の森岡新(研究当時),金沢大学ナノ生命科学研究所(WPI-NanoLSI)/新学術創成研究機構の柴田幹大教授らの研究グループは,東京大学定量生命科学研究所の胡桃坂仁志教授らの研究グループとの共同研究で,遺伝子発現制御に重要なヒストンテールを除去したヌクレオソーム(※1)が,わずか0.3 秒以内の時間スケールで「ヌクレオソームスライディング」や「DNA アンラッピング・ラッピング」を頻度よく起こすことを高速原子間力顕微鏡(高速 AFM)(※2)を用いて世界で初めて明らかにしました。
各ヒストンタンパク質(H2A, H2B, H3, H4)の末端には,それぞれ長さの異なるひも状構造(ヒストンテール(※3))があります。このヒストンテールの化学的な変化(翻訳後修飾(※4))は,生命の本質とも言える遺伝子発現制御に重要であると考えられていますが,ヒストンテール自体がヌクレオソーム構造にどのような影響を与えるのかは不明でした。そこで本研究では,全てのヒストンテールや,各ヒストンタンパク質のテールを除去したヌクレオソームをそれぞれ作製し,高速 AFM を用いてナノメートルスケールでの動態観察を行いました。その結果,0.3 秒以内で起こる自発的なヌクレオソームスライディング(ヒストン八量体が DNA に沿って移動する現象)や DNA アンラッピング現象の動画撮影に成功しました。特に, H2B と H3 のヒストンテールの除去がヌクレオソームのナノダイナミクスに大きく関与していることを明らかにしました。高速 AFM 観察により,ヒストンテールそれ自体がヌクレオソームの動的な構造変化に深く関わっていることを明らかにしました。本研究結果は,今後,エピジェネティックな遺伝子発現制御の分子メカニズム解明へ向けて新しい知見を提供することが期待されます。
本研究成果は,2024 年 4 月 11 日(米国東部時間)に国際学術誌『Nano Letters』のオンライン版に掲載されました。
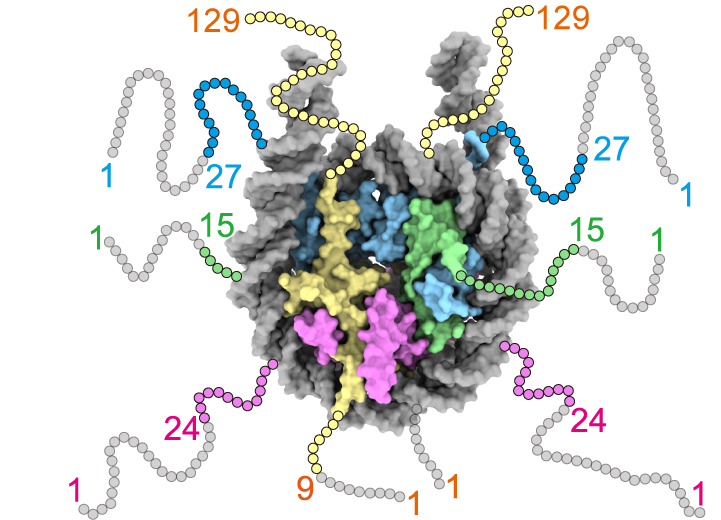
ヌクレオソームは,ヒストンH2A-H2B二量体二つとH3-H4二量体二つからなるヒストン八量体にDNAが巻き付いた複合体であり,各ヒストンの末端にはヒストンテールと呼ばれる柔軟な領域がある。本研究で用いたヒストンテール欠損変異体のアミノ酸位置を,灰色の丸で示す。H2A:黄色, H2B:マゼンタ, H3:シアン, H4:緑色, DNAは灰色で示す。
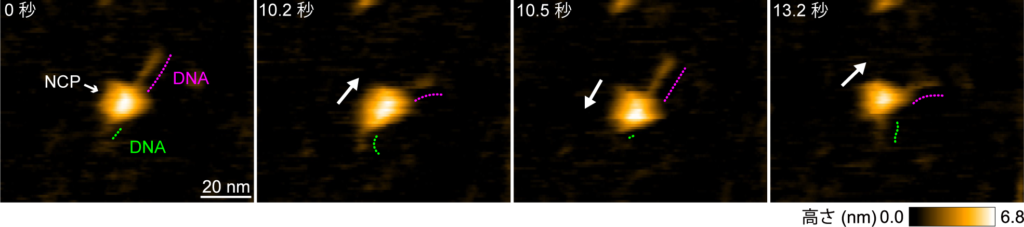 図2: 全てのヒストンテールを除去したallテールレスヌクレオソームの連続した高速AFM動画
図2: 全てのヒストンテールを除去したallテールレスヌクレオソームの連続した高速AFM動画
1フレーム0.3秒で撮影。高速AFMの映像より,球状構造(NCP)が,DNA上に沿って自発的にスライディングする様子を撮影した。原著論文では動画で見ることができる。© 2024 American Chemical Society
【用語解説】
※1:ヌクレオソーム
クロマチンの基本構成単位で,H2A, H2B, H3, H4 の 4 種類がそれぞれ 2 分子ずつ,計 8個のヒストンタンパク質が集合し,その周囲に DNA が巻き付いた複合体を指す。ヒストンが「糸巻き」のような役割を持つことによって,非常に長い鎖状の DNA が細胞核内にコンパクトに収納される。
※2:高速原子間力顕微鏡(高速 AFM)
試料の表面を直径数ナノメートルの探針でなぞることで,表面形状を可視化する接触型顕微鏡。溶液中にある生体分子を,ナノメートルの空間分解能と高い時間分解能(最速 33フレーム/秒)でスキャンすることが可能であり,試料の構造と動きの両方を可視化することができる。
※3:ヒストンテール
ヒストンタンパク質の N 末端・C 末端にある柔らかく,決まった構造を持たない領域。さまざまな部位のアミノ酸残基が,アセチル化などのさまざまな翻訳後修飾を受けることでクロマチン構造を変化させ,遺伝子発現の制御が行われる。
※4:翻訳後修飾
タンパク質が合成された後(翻訳後)に,そのタンパク質を構成するアミノ酸残基にアミノ基やリン酸基などが付加される現象のこと。
ジャーナル名:Nano Letters
研究者情報:柴田 幹大




 PAGE TOP
PAGE TOP