金沢大学ベンチャービジネスラボラトリーの家崎高志博士研究員,金沢大学医薬保健研究域薬学系の金田勝幸教授,檜井栄一准教授らの研究グループは,京都大学ウイルス・再生医科学研究所の大野睦人教授,北畠真助教,金沢医科大学の石垣靖人教授,中京学院大学の眞部孝幸教授らとの共同研究により,私たちの体の“かたち”づくりに重要なシグナルと新しい分子メカニズムを発見しました。
私たちの体は,さまざまな要因が複雑に絡み合って精巧に“かたち”づくられています。骨格はその“かたち”づくりの最も基本的な構造です。骨格の形成に重要なシグナルはこれまでいくつか明らかになっていましたが,ライフスタイルに起因する栄養環境シグナルが,どのように骨格の形成に関与しているかについては明らかになっていませんでした。
本研究グループは,マウスジェネティクス(※1)と生化学的解析を組み合わせることにより,栄養環境シグナルを統合する Mechanistic target of rapamycin(mTOR)(※2)という因子が,骨格の形成に重要な役割を果たしていることを見いだしました(図1)。また,詳細な解析を行った結果,mTORC1不活性化細胞ではポリソーム(※3)におけるSox9(※4)のRNA量が著しく減少しており,Sox9のRNA翻訳が抑制されていることを発見。さらに,その翻訳制御には,4E-BPs(※5)経路が関与していることを明らかにしました(図2)。
本成果は,「私たちの体はどのように“かたち”づくられて,どのように維持されているのか」という疑問に対して新たな概念を提供するとともに,“かたち”の形成異常や,その恒常性維持の破綻によって引き起こされるさまざまな骨系統疾患に対する新しい知見と解決法を提供し,アンメット・メディカル・ニーズ(※6)の解消に貢献することが期待されます。
本研究成果は,2018年6月29日午前1時(日本時間)に,米国学術雑誌『Stem Cell Reports』のオンライン版に掲載されました。
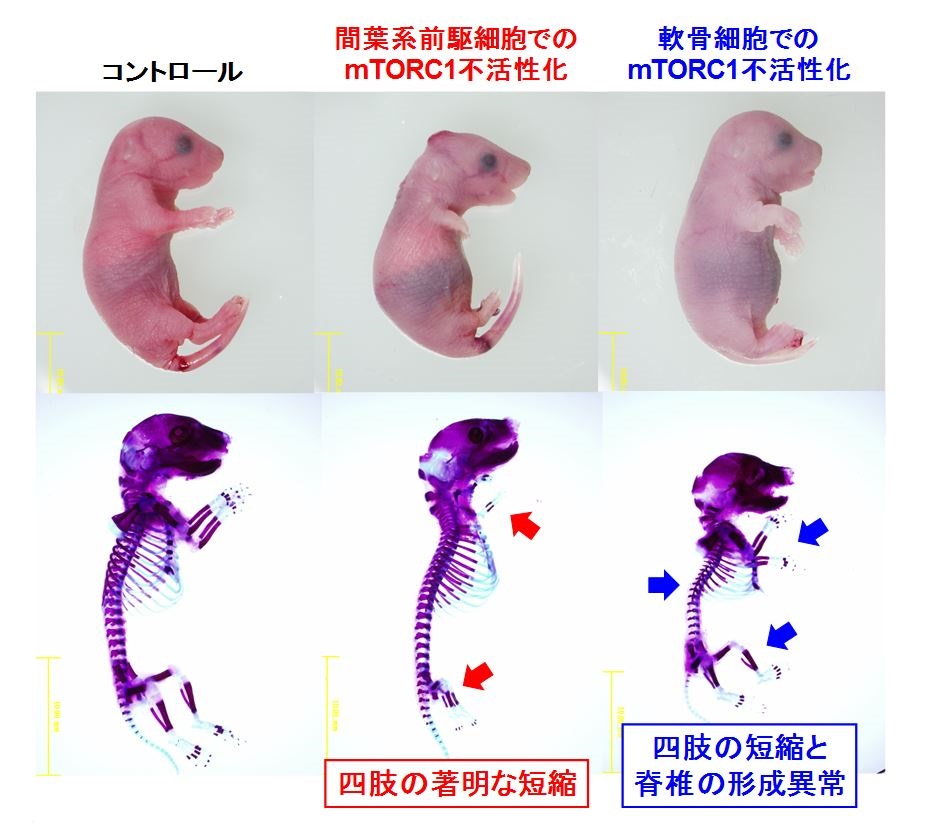
図1 胎生18.5日目のマウス胎児の骨格標本
間葉系前駆細胞特異的なmTORC1不活性化マウスを作製したところ,手足がほとんど形成されないという劇的な表現型を示し(中央:赤色矢印),さらに,軟骨細胞特異的なmTORC1不活性化マウスを作製すると,手足の形成不全だけでなく,脊椎の形成異常が確認されました(右:青色矢印)。この結果から,mTORC1シグナルは骨格の形成にとても重要であることが明らかになりました。
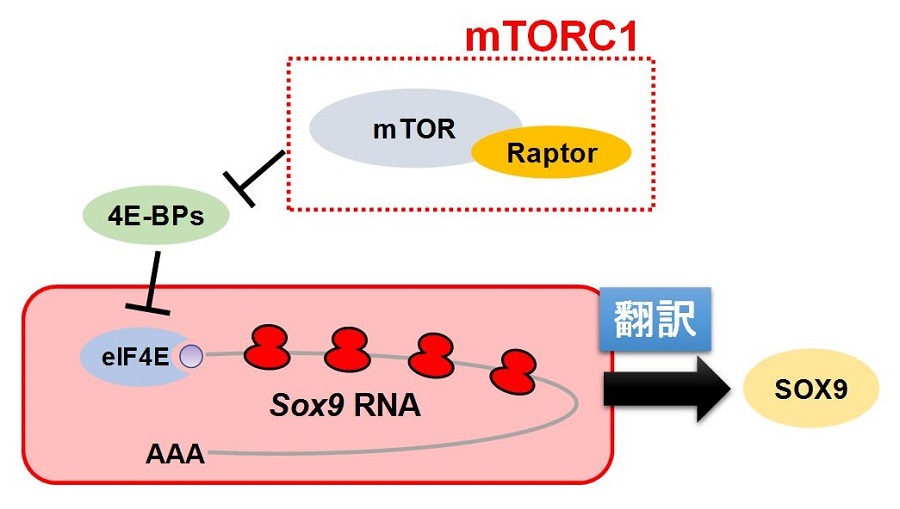
図2 mTORC1/4E-BPs経路によるSox9のRNA翻訳調節
【用語解説】
※1 マウスジェネティクス
遺伝子を操作したねずみ(マウス)を用いた実験。
※2 Mechanistic target of rapamycin(mTOR)
細胞の成長,増殖,生存,分化などのさまざまな機能を調節する酵素。複数のタンパク質による複合体(complex)を形成し,その複合体はmTORCと呼ばれる。
※3 ポリソーム
翻訳の場であるリボソームがmRNAによって複数個つながれたもの。
※4 Sox9
Soxと呼ばれる,骨格の形成に中心的な役割を果たしている遺伝子グループの一つ。Sox遺伝子の9番目。
※5 4E-BPs
翻訳開始因子であるeIF4Eと複合体を形成することで,翻訳を抑制する機能を持つ。
※6 アンメット・メディカル・ニーズ
未だ有効な治療方法が確立されていない疾病に対する医療への要望。




 PAGE TOP
PAGE TOP