金沢大学ナノ生命科学研究所の紺野宏記准教授,中山隆宏准教授および安藤敏夫特任教授と,東京工業大学生命理工学院生命理工学系の奥田桃子大学院生(研究当時:博士後期課程3年)および田口英樹教授らの研究グループは,高速原子間力顕微鏡(高速AFM)(※1)で出芽酵母のプリオン(※2)タンパク質が多量体やアミロイド線維(※3)を形成する状況を観察することに成功し,今まで不明だったアミロイド線維形成メカニズムの一端を解明しました。
生命活動はタンパク質の機能によって成り立っています。タンパク質は特定の形を形成して働くのが基本ですが,老化などの原因で異常な立体構造になることがあります。異常構造の一つは,「アミロイド」という線維状のタンパク質であり,多くの病気に関係することが分かっていますが,どのような仕組みで線維が形成されていくのかについてはこれまで明らかにされていませんでした。
本研究グループは,高速AFMを用いて出芽酵母のプリオンタンパク質がアミロイド線維を形成する状況を直接観察した結果,プリオンタンパク質の単量体が立体構造を取らない状態でアミロイド線維の末端に結合し,これによりアミロイド線維が伸びることを示唆する結果を得ました。
本成果は,アミロイド線維というタンパク質の異常状態ができるメカニズムの解明に貢献するとともに,クロイツフェルト・ヤコブ病(※4)や狂牛病といったプリオン病,アルツハイマー病などのアミロイド線維が関わる病気に関する病態の解明などさまざまな波及効果が期待できます。
本研究成果は2020年3月23日に『Proceedings of the National Academy of Sciences of United States of America(米国科学アカデミー紀要)』のオンライン版に掲載されました。
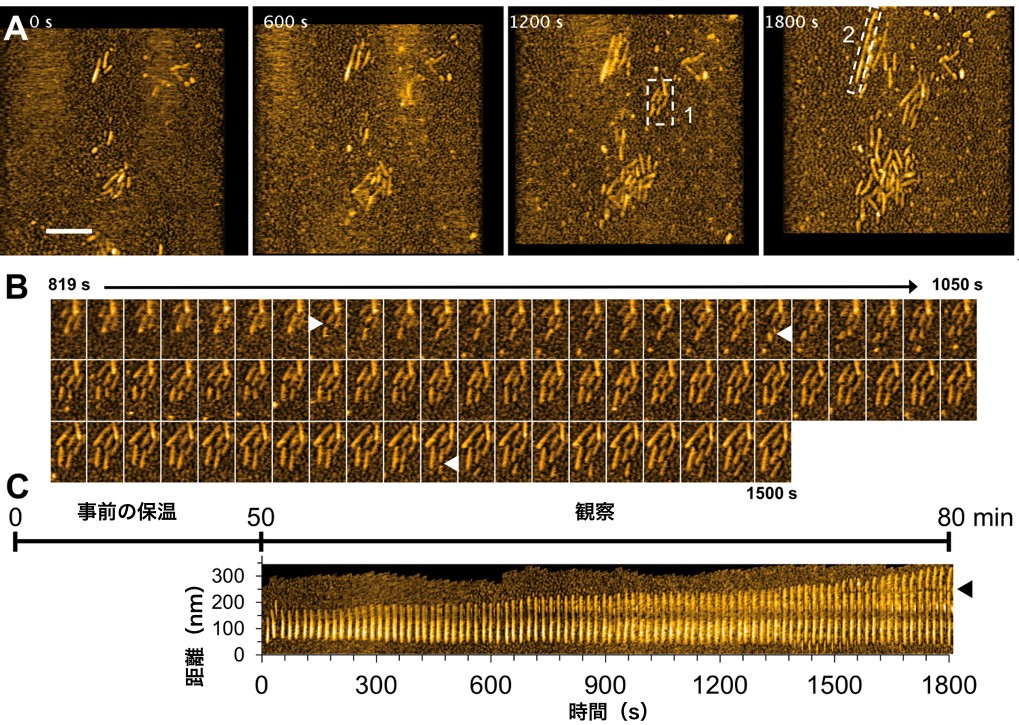
図1. 酵母プリオンタンパク質が形成するアミロイド線維が伸びる様子の高速AFM観察
A. 高速AFMで観察した酵母プリオンタンパク質Sup35のアミロイド伸長の様子。600秒おきに観察。
B. Aの点線で囲った1の領域のみを抜き出し,より高い時間分解能で観察したスナップショット。白色の矢頭は線維が分断した部分を示す。
C. Aの点線で囲った2の領域を抜き出し,時間ごとに並べた図。黒色の矢頭は線維が分断した部分を示す。
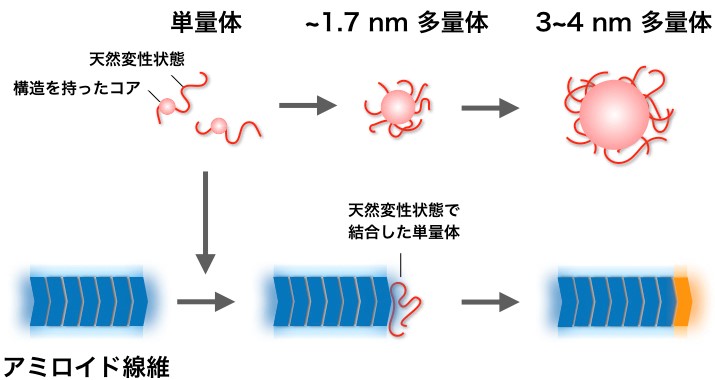
図2. 酵母プリオンタンパク質が作る多量体とアミロイド線維の形成機構のモデル
単量体(赤)は直径約1.7 nmの多量体を経て直径約3~4 nmの多量体になる。その一方,単量体は天然変性状態でアミロイド線維(青)の末端に結合したのちに構造変換して線維の一部となり,線維が伸長する(オレンジ)。
【用語解説】
※1 高速原子間力顕微鏡(高速AFM)
探針と試料の間に働く原子間力を元に分子の形状をナノメートル(10-9 m)程度の高い空間分解能で可視化する顕微鏡。高速AFMは,安藤敏夫特任教授のグループによって開発された超高速で観察できるAFMで,サブ秒(~0.1秒)という時間分解能でタンパク質などの生体分子の形状や動態を観察することできる。
※2 プリオン
タンパク質性の感染因子のことで,クロイツフェルト・ヤコブ病や狂牛病など哺乳類の神経変性疾患研究から見つかってきた。プリオンでは何らかの原因で生じた異常型構造(アミロイド線維)のタンパク質が自己触媒的に正常型を異常型に変換しながら増殖する。
※3 アミロイド線維
分子間でβシートが規則正しく重合したタンパク質の線維構造のこと。通常タンパク質はある特定の立体構造を形成して機能を発揮するが,アミロイド線維では,その立体構造とは全く異なる構造状態となる。
※4 クロイツフェルト・ヤコブ病
ヒトの脳内にプリオンタンパク質のアミロイド構造が沈着し,脳の機能に障害が起こる致死性の病気。どのような作用機序でアミロイドが増殖して発症に至るのかよく分かっておらず,治療法はまだない。
Proceedings of the National Academy of Sciences of United States of America(米国科学アカデミー紀要)
研究者情報:紺野 宏記
研究者情報:中山 隆宏
研究者情報:安藤 敏夫




 PAGE TOP
PAGE TOP