金沢大学医薬保健研究域薬学系の加藤将夫教授と,東京大学および産業技術総合研究所の共同研究グループは,複数臓器細胞の生体模倣システム(※1)を用いてヒトの体内での薬物の動き(薬物動態)を明らかにする手法の開発に成功しました。
新しい薬が創られるまでには,さまざまな段階の調査と検査が必要となります。中でも,ヒトを対象とした臨床試験を行う前に,実験動物や培養細胞などを用いて薬物動態やその効果,副作用を予測することは重要なステップです。特に,薬物動態は実験動物とヒトとの違いが極めて大きいことから,臨床試験に入る前の予測の精度が求められます。生体模倣システムは,複数の臓器を同時に循環培養(※2)することにより,ヒトの生体により近い環境での評価が可能となります。しかし,生体模倣システムで得られた結果をどのように評価し,ヒトでの薬物動態の予測に結び付けるかについては,これまで十分な理解が得られていませんでした。
本研究では,消化管と肝臓のモデル細胞を循環培養した生体模倣システムを構築し,精神安定剤のトリアゾラムについて,消化管での吸収と肝臓での分解(代謝)の過程を追跡調査しました。その結果,トリアゾラムが体内に吸収され,肝臓で代謝される様子を再現することができました。さらに,数学モデルと組み合わせた定量的な解析を行うことにより,トリアゾラムのヒト生体内での吸収・代謝過程を再現できることも明らかにしました。
本研究は,生体模倣システムを用いてヒトでの薬物動態を定量的にシミュレーションした初めての成果です。今後は,より生体に近いシステムに改良を重ねることで,医薬品開発の成功率を高めるデバイスとして発展することが期待されます。
本研究成果は,2020年1月13日(英国時間)に国際学術誌『Lab on a Chip』のオンライン版に掲載されました。
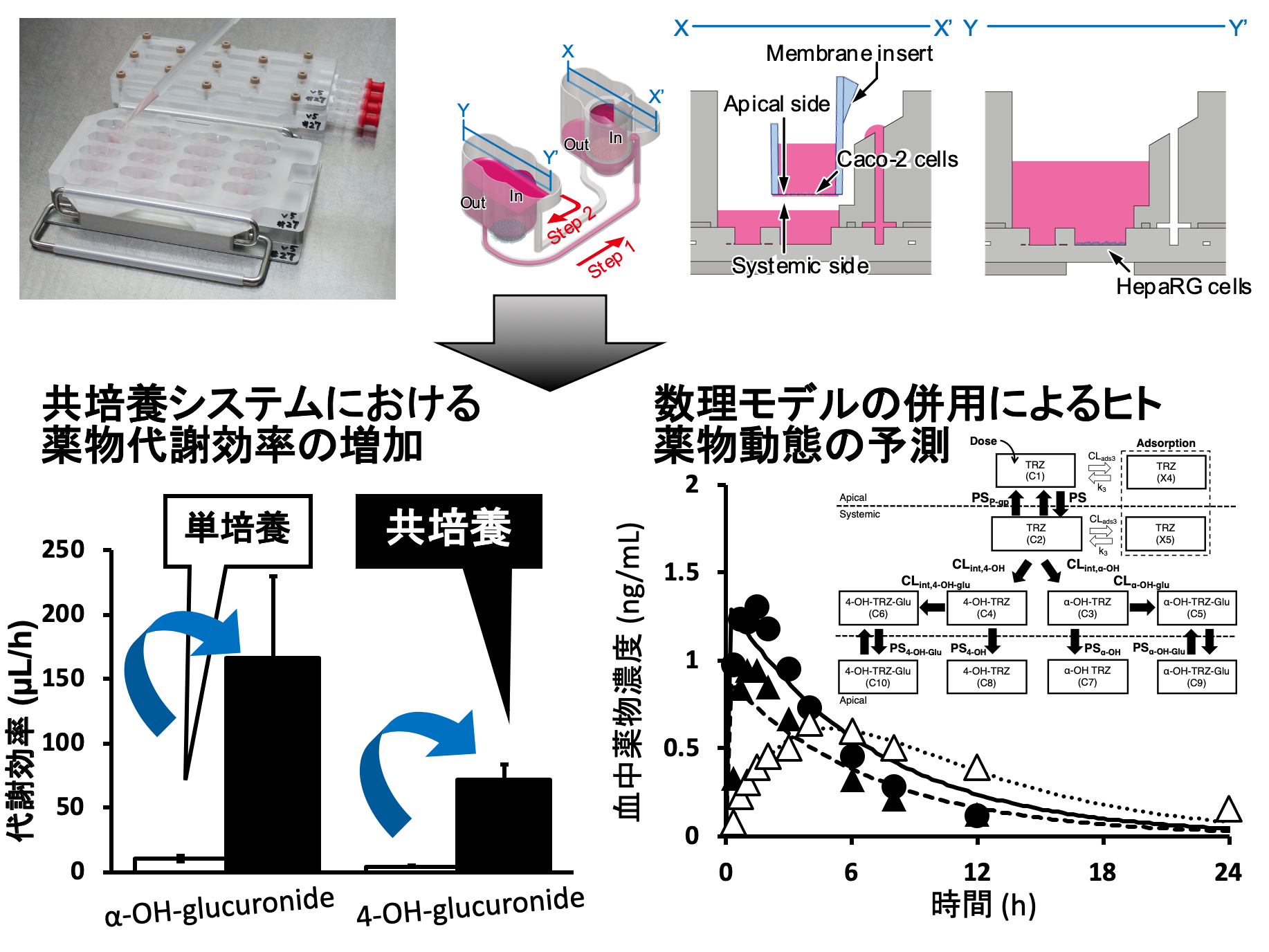
図1. 生体模倣システムを用いたヒト生体内での薬物動態の予測
生体模倣システム(左上:写真、右上:概念図)に薬物を添加した後の薬物や代謝物を追跡した。数理モデルと組み合わせることでヒト薬物動態の予測につながる(右下)一方,共培養によって薬物代謝効率が増加し,ヒトでの代謝効率に近づくこと(左下)を示した。
※1 生体模倣システム
Microphysiological system(MPS。生理学的マイクロ細胞培養システム)とも総称される。生体内での細胞の微小環境を再現するため,培養液の流れや,他の細胞との共培養などを試みた細胞培養システム。
※2 循環培養
複数の細胞同士を,血液の流れを模倣した流路でつなぎ,そこに培養液を灌流させて細胞を培養すること。生体に近い生理的な実験系として期待されるとともに,複数の細胞同士の相互作用を解明する研究ツールとしても用いられている。
研究者情報:加藤 将夫




 PAGE TOP
PAGE TOP