金沢大学ナノ生命科学研究所のキイシヤン・リン特任助教とナノ生命科学研究所/新学術創成研究機構のリチャード・ウォング教授らの共同研究グループは,高速原子間力顕微鏡(HS-AFM)(※1)により,ヒトインフルエンザAヘマグルチニン(HA,※2)の分子ナノ動態と,HAがエキソソーム(※3)と相互作用する瞬間のナノ動態を可視化することに成功しました。
HAは,インフルエンザAウイルス(IAV)の中で最も注意すべき病原性因子の1つであり,宿主との親和性,感染力,伝染性,およびパンデミックを起こすリスクは,HAの特性に依存しています。HAは,IAVが宿主細胞に感染する際に,極めて重要な役割を果たすと考えられてきましたが,感染過程でHAが経時的に起こす構造変化のメカニズムの詳細は,明らかにされていませんでした。
本研究では,HS-AFMを用いて,pHが中性の溶液中では楕円体だったHAが,酸性の溶液中では立体構造が変化することを発見し,HAとエキソソームの相互作用のナノ分子動態を解明しました。また,HS-AFMによるHAのリアルタイム立体構造変化の可視化により,この変化が「アンケージング」モデル(※4)であり,HAの中間体がY字型であることを見いだしました。さらに,本研究成果により,HS-AFMイメージングは,少ないサンプル量でも医療診断に使用可能であることが分かり,HS-AFMがウイルス融合タンパク質のナノ分子動態を解析するだけでなく,ウイルス融合タンパク質とその標的となる細胞の膜との相互作用を可視化するための実行可能なツールであることが明らかになりました。将来的にはIAVタンパク質が宿主の核内に侵入する際の,核膜孔複合体(NPC,※5)との相互作用のみならず,他のウイルス構成分子と宿主タンパク質の相互作用も,HS-AFMを用いて視覚化が可能になると考えられます。
これらの知見は将来,新型コロナウイルス感染症(COVID-19)における感染メカニズムの解明に活用されることが期待されます。
本研究成果は,2020年8月6日(米国東海岸標準時間)に米国科学誌『Nano Letters』のオンライン版に掲載されました。
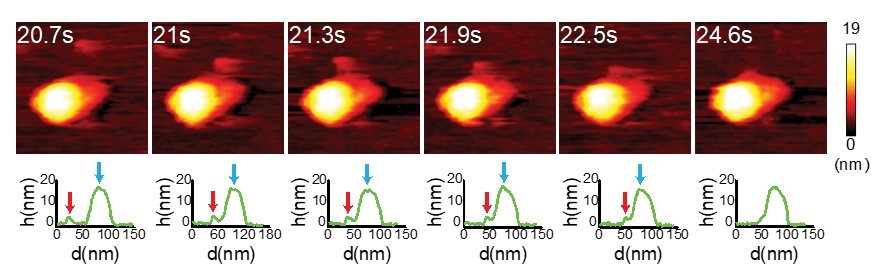
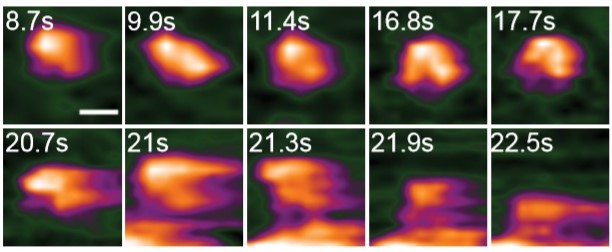
図1. インフルエンザのHAタンパク質がエキソソーム膜表面に融合する瞬間を,世界で初めて直接観察することに成功した。
拡大画像シーケンスは,エキソソームと融合したときのHAタンパク質の構造変化を示す。((C)Nano Letters )
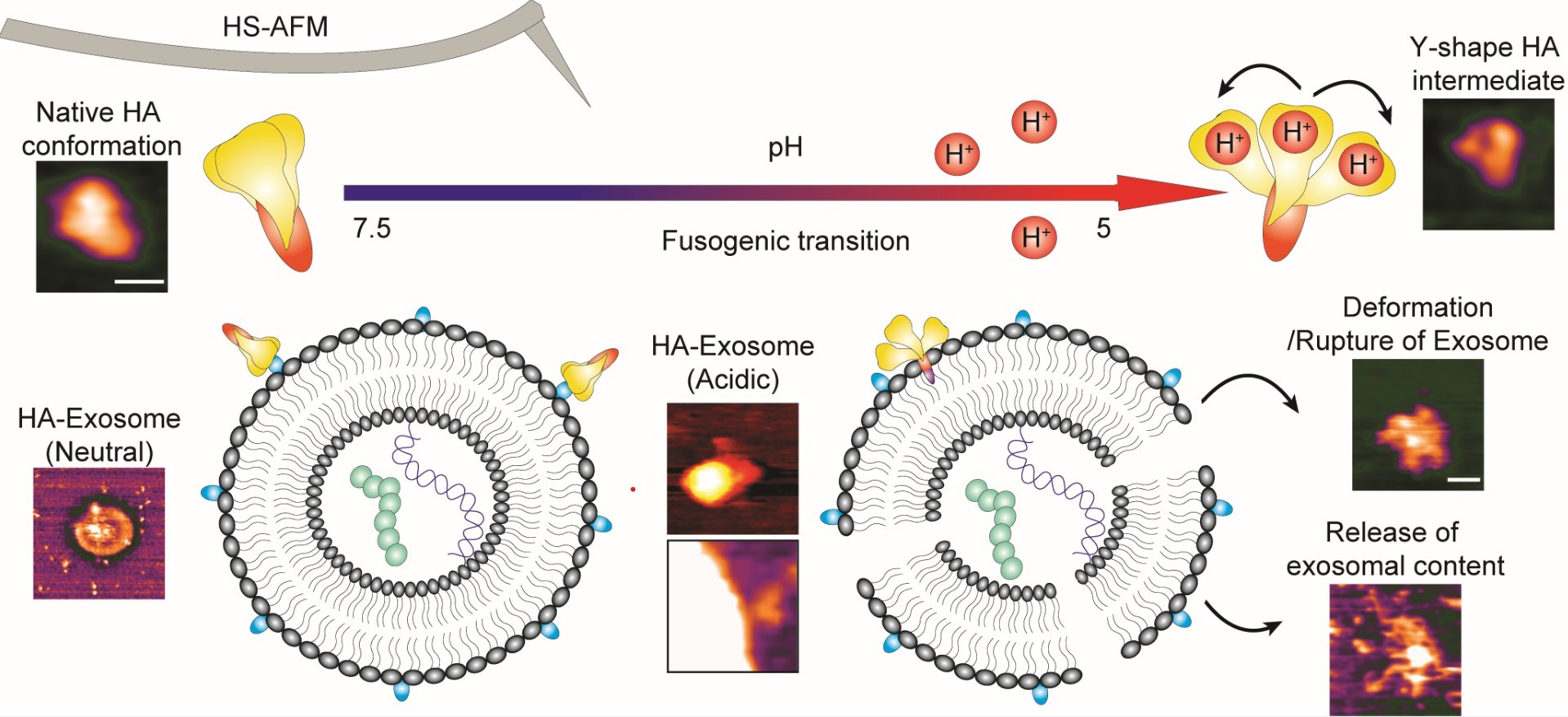
図2. 概要図
HS-AFMを使用した,HAのネイティブなコンフォメーション,その融合性遷移,および酸性環境でのエキソソームとのリアルタイムでの相互作用の直接的な可視化。HA1サブユニットのプロトン化はHA1サブユニットの解離を引き起こし,次に融合ペプチドがエキソソームに挿入され,エキソソームの変形または破裂を引き起こし,エキソソーム内の内容物が漏出する。((C)Nano Letters )
【用語解説】
※1 高速原子間力顕微鏡(HS-AFM)
探針と試料の間に働く原子間力を基に分子の形状をナノメートル(10-9 m)程度の高い空間分解能で可視化する顕微鏡。溶液中で動いているタンパク質などの生体分子をナノメートルの空間分解能とサブ秒という時間分解能で観察することが可能である。
※2 ヒトインフルエンザAヘマグルチニン(HA)
インフルエンザウイルスの表面上に存在する抗原性糖タンパク質。HAは,ホモ三量体のタンパク質であり,これらの生合成にはまず1つの前駆体が合成される。この前駆体は,後に分裂し,HA1とHA2の2つの主要サブユニットが生成される。
※3 エキソソーム/細胞外小胞
細胞が分泌する脂質二重膜に覆われた小胞のこと。分泌細胞由来のタンパク質やRNAなどの核酸,脂質などを含んでおり,さまざまな細胞間情報伝達を担っている。
※4 「アンケージング」モデル
インフルエンザウイルスが宿主細胞に感染する際,ヘマグルチニン(HA)が宿主細胞膜に接触し融合する。細胞膜へ接触する際,HAがサブユニットHA1を解離することにより融合を開始,融合ペプチドを放出し,膜融合活性を持つヘアピン構造の中間体を生成するモデルを「アンケージング」モデルという。
※5 核膜孔複合体(NPC)
細胞核を覆う膜にある穴である核膜孔を構成するタンパク質の集合体。普段は細胞質と核の間の物質輸送を担う。
研究者情報:キイシヤン・リン
研究者情報:リチャード・ウォング




 PAGE TOP
PAGE TOP